Oxygène
| Oxygène | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Oxygène liquide dans un bécher. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Symbole | O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nom | Oxygène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Numéro atomique | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Groupe | 16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Période | 2e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bloc | Bloc p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Famille d'éléments | Non-métal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Configuration électronique | [He] 2s2 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Électrons par niveau d’énergie | 2, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Masse atomique | 15,9994 ± 0,0003 u[1] (atome O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rayon atomique (calc) | 60 pm (48 pm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rayon de covalence | 66 ± 2 pm[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rayon de van der Waals | 140 pm[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
État(s) d’oxydation | -2, -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Électronégativité (Pauling) | 3,44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Énergies d’ionisation[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1re : 13,61805 eV | 2e : 35,1211 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3e : 54,9355 eV | 4e : 77,41353 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5e : 113,8990 eV | 6e : 138,1197 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
7e : 739,29 eV | 8e : 871,4101 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
État ordinaire | gaz paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Allotrope à l'état standard | Dioxygène O2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Autres allotropes | Ozone O3, oxygène singulet O2*, ozone cyclique O3, tétraoxygène O4, octaoxygène O8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Masse volumique | 1,42763 kg·Nm-3 T.P.N. (molécule O2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Système cristallin | Cubique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Couleur | incolore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Point de fusion | −218,79 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Point d’ébullition | −182,95 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Énergie de fusion | 0,22259 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Énergie de vaporisation | 3,4099 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Température critique | −118,56 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Pression critique | 5,043 MPa[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Point triple | −218,79 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Volume molaire | 22,414×10-3 m3·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vitesse du son | 317 m·s-1 à 20 °C,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chaleur massique | 920 J·kg-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Conductivité thermique | 0,02674 W·m-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
SGH[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dioxygène O2 :   Danger H270, H280, P220, P244, P370+P376, P403, H270 : Peut provoquer ou aggraver un incendie ; comburant H280 : Contient un gaz sous pression ; peut exploser sous l'effet de la chaleur P220 : Tenir/stocker à l’écart des vêtements/…/matières combustibles P244 : S’assurer de l’absence de graisse ou d’huile sur les soupapes de réduction. P370+P376 : En cas d’incendie : obturer la fuite si cela peut se faire sans danger. P403 : Stocker dans un endroit bien ventilé. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Transport[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dioxygène O2 :
Code Kemler : 25 : gaz comburant (favorise l'incendie) Numéro ONU : 1072 : OXYGÈNE COMPRIMÉ Classe : 2.2 Étiquettes :  2.2 : Gaz ininflammables, non toxiques (correspond aux groupes désignés par un A ou un O majuscule);  5.1 : Matières comburantes Emballage : -
Code Kemler : 225 : gaz liquéfié réfrigéré, comburant (favorise l'incendie) Numéro ONU : 1073 : OXYGÈNE LIQUIDE RÉFRIGÉRÉ Classe : 2.2 Étiquettes :  2.2 : Gaz ininflammables, non toxiques (correspond aux groupes désignés par un A ou un O majuscule);  5.1 : Matières comburantes Emballage : - | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'oxygène est l'élément chimique de numéro atomique 8, de symbole O. C'est la tête de file du groupe des chalcogènes, souvent appelé groupe de l'oxygène. Découvert indépendamment en 1772 par le Suédois Carl Wilhelm Scheele à Uppsala et en 1774 par le Britannique Joseph Priestley dans le Wiltshire, l'oxygène a été nommé ainsi en 1777 par Antoine Lavoisier ainsi que son épouse à Paris à partir du grec ancien ὀξύς / oxys (« aigu », c'est-à-dire ici « acide »), et γενής / genês (« générateur »), car Lavoisier pensait à tort que[7] :
« Nous avons donné à la base de la portion respirable de l'air le nom d'oxygène, en le dérivant de deux mots grecs ὀξύς, acide et γείνομαι, j'engendre, parce qu'en effet une des propriétés les plus générales de cette base [Lavoisier parle de l'oxygène] est de former des acides en se combinant avec la plupart des substances. Nous appellerons donc gaz oxygène la réunion de cette base avec le calorique. »
Une molécule de formule chimique O2, appelée communément « oxygène » et, par les chimistes, dioxygène est constituée de deux atomes d'oxygène reliés par liaison covalente : aux conditions normales de température et de pression, le dioxygène est un gaz, qui constitue 20,8 % du volume de l'atmosphère terrestre au niveau de la mer.
L'oxygène est un non-métal qui forme très facilement des composés, notamment des oxydes, avec pratiquement tous les autres éléments chimiques. Cette facilité se traduit par des énergies de formation élevées mais, cinétiquement, le dioxygène est souvent peu réactif à température ambiante. Ainsi un mélange de dioxygène et de dihydrogène, de fer ou de soufre, etc., n'évolue qu'extrêmement lentement.
C'est, en masse, le troisième élément le plus abondant de l'Univers après l'hydrogène et l'hélium, et le plus abondant des éléments de l'écorce terrestre ; l'oxygène constitue ainsi sur Terre[8] :
- 86 % de la masse des océans, sous la forme d'eau ;
- 46,4 % de la masse de l'écorce terrestre, en particulier sous forme d'oxydes et de silicates ;
- 23,1 % de la masse de l'air, sous forme de dioxygène ou d'ozone, soit 1,2 × 1015 tonnes, soit près de 21 % du volume total de l'atmosphère ;
- 62,5 % de la masse du corps humain ;
- jusqu'à 88 % de la masse de certains animaux marins.
La Terre était à l'origine dépourvue de dioxygène. Celui-ci s'est formé grâce à la photosynthèse réalisée par les végétaux, les algues et les cyanobactéries, ces dernières étant apparues il y a peut-être 2,8 milliards d'années[9]. Le dioxygène O2 est toxique pour les organismes anaérobies, dont faisaient partie les premières formes de vie apparues sur Terre, mais est indispensable à la respiration des organismes aérobies, qui constituent la grande majorité des espèces vivantes actuelles. La respiration cellulaire est l'ensemble des voies métaboliques, telles que le cycle de Krebs et la chaîne respiratoire, alimentées par exemple par la glycolyse et la β-oxydation, par lesquelles une cellule produit de l'énergie sous forme d'ATP et du pouvoir réducteur sous forme de NADH + H+ et de FADH2.
En s'accumulant dans l'atmosphère terrestre, le dioxygène O2 issu de la photosynthèse a formé une couche d'ozone à la base de la stratosphère sous l'effet du rayonnement solaire. L'ozone est un allotrope de l'oxygène de formule chimique O3 encore plus oxydant que le dioxygène — ce qui en fait un polluant indésirable lorsqu'il est présent dans la troposphère au niveau du sol — mais qui a la particularité d'absorber les rayons ultraviolets du Soleil et donc de protéger la biosphère de ce rayonnement nocif : la couche d'ozone a constitué le bouclier qui a permis aux premières plantes terrestres de quitter les océans il y a près de 475 millions d'années.
Sommaire
1 Élément
1.1 Isotopes et origine stellaire
1.2 Utilisation de l'oxygène 18
1.3 Importance de la présence de l'oxygène
2 Corps simple
2.1 Structure
2.2 Allotropes
2.3 Propriétés physiques
3 Historique
3.1 Premières expériences
3.2 Phlogistique
3.3 Découverte
3.4 Contribution de Lavoisier
3.5 Histoire récente
4 Notes et références
4.1 Notes
4.2 Références
5 Voir aussi
5.1 Bibliographie
5.2 Articles connexes
5.3 Liens externes
Élément |
Isotopes et origine stellaire |

Vue en coupe d'une étoile évoluée caractérisée par des coquilles concentriques de différents éléments. Tardivement dans la vie d'une étoile, l'oxygène 16 se concentre dans la coquille "O", l'oxygène 17 dans la coquille "H" et l'oxygène 18 dans la coquille "He".
L'oxygène possède dix-sept isotopes dont le nombre de masse varie de 12 à 28. L'oxygène d'origine naturelle est composé de trois isotopes stables : l'oxygène 16 16O, l'oxygène 17 17O et l'oxygène 18 18O. On attribue en outre à l'oxygène une masse atomique standard de 15,9994 u[10]. L'oxygène 16 est le plus abondant, son abondance naturelle étant de 99,762 %[11].
La majorité de l'oxygène 16 est synthétisée à la fin du processus de fusion de l'hélium au sein d'étoiles massives mais une partie est aussi produite lors des réactions de fusion du néon[12]. L'oxygène 17 est principalement issu de la fusion de l'hydrogène en hélium au cours du cycle CNO. Il s'agit donc d'un isotope courant des zones de combustion de l'hydrogène des étoiles[12]. La majorité de l'oxygène 18 est produite quand l'azote 14 14N rendu abondant par le cycle CNO capture un noyau d'hélium 4 4He. L'oxygène 18 est donc couramment présent dans les zones riches en hélium des étoiles massives évoluées[12].
Quatorze radioisotopes ont été mis en évidence. Les plus stables sont l'oxygène 15 15O ayant la plus longue demi-vie (122,24 secondes) et l'oxygène 14 14O ayant une demi-vie de 70,606 secondes[11]. Tous les autres isotopes radioactifs ont des demi-vies inférieures à 27 s et la majorité d'entre eux a des demi-vies de moins de 83 millisecondes[11]. L'oxygène 12 12O à la durée de vie la plus courte (580×10−24 s)[13]. Le type de décroissance radioactive le plus répandu chez les isotopes plus légers que l'oxygène 16 est l'émission de positron[14],[15],[16] produisant de l'azote. Le type de décroissance le plus courant pour les isotopes plus lourds que l'oxygène 18 est la radioactivité β donnant naissance à du fluor[11].
Utilisation de l'oxygène 18 |
L'oxygène 18 est un indicateur paléoclimatique utilisé pour connaître la température dans une région à une époque donnée : plus le rapport isotopique 18O / 16O est élevé et plus la température correspondante est basse. Ce rapport peut être déterminé à partir de carottes de glace, ainsi que de l'aragonite ou de la calcite de certains fossiles.
Ce procédé est très utile pour confirmer ou infirmer une théorie sur les changements climatiques naturels terrestres comme les paramètres de Milanković.
Comme marqueur isotopique stable, il a été utilisé pour mesurer le flux unidirectionnel d'oxygène absorbé, pendant la photosynthèse, par le phénomène de photorespiration. Il a été montré que, avant l'augmentation de CO2 de l'ère industrielle, la moitié de l'oxygène émis par les feuilles était réabsorbée. Cela réduisait le rendement de la photosynthèse de moitié (Gerbaud and André, 1979-1980)[17],[18].
Importance de la présence de l'oxygène |
| Z | Élément | Fraction de masse en parties par million |
|---|---|---|
| 1 | Hydrogène | 739 000 |
| 2 | Hélium | 240 000 |
| 8 | Oxygène | 10 400 |
| 6 | Carbone | 4 600 |
| 10 | Néon | 1 340 |
| 26 | Fer | 1 090 |
| 7 | Azote | 960 |
| 14 | Silicium | 650 |
| 12 | Magnésium | 580 |
| 16 | Soufre | 440 |
L'oxygène est l'élément chimique le plus abondant du point de vue de la masse dans la biosphère, l'air, l'eau et les roches terrestres. Il est aussi le troisième élément le plus abondant de l'univers après l'hydrogène et l'hélium[20] et représente environ 0,9 % de la masse du Soleil[21]. Il constitue 49,2 % de la masse de la croûte terrestre[22] et est le principal constituant de nos océans (88,8 % de leur masse)[21]. Le dioxygène est le second composant le plus important de l'atmosphère terrestre, représentant 20,8 % de son volume et 23,1 % de sa masse (soit quelque 1015 tonnes)[21],[20],[a]. La Terre, en présentant un taux si important d'oxygène gazeux dans son atmosphère, constitue une exception au sein des planètes du système solaire : l'oxygène des planètes voisines Mars (qui ne représente que 0,1 % du volume de son atmosphère) et Vénus y a des concentrations bien plus faibles. Toutefois, le dioxygène entourant ces autres planètes est seulement produit par les rayons ultraviolets agissant sur les molécules contenant de l'oxygène comme le dioxyde de carbone.
La concentration importante et inhabituelle de dioxygène sur Terre est le résultat des cycles de l'oxygène. Ce cycle biogéochimique décrit les mouvements du dioxygène à l'intérieur et entre ses trois principaux réservoirs sur Terre : l'atmosphère, la biosphère et la lithosphère. Le facteur principal de la réalisation de ces cycles est la photosynthèse qui est le principal responsable de la teneur actuelle en dioxygène sur Terre[23]. Le dioxygène est indispensable à tout écosystème : les êtres vivants photosynthétiques dégagent du dioxygène dans l'atmosphère alors que la respiration et la décomposition des animaux et des plantes en consomme. Dans l'équilibre actuel, la production et la consommation se réalisent dans les mêmes proportions : chacun de ces transferts correspond à environ 1/2000 de la totalité de l'oxygène atmosphérique chaque année[24]. Enfin, l'oxygène est un composant essentiel des molécules qui se retrouvent dans tout être vivant : acides aminés, sucres, etc.[25].
L'oxygène joue également un rôle important dans le milieu aquatique. L'augmentation de la solubilité de l'oxygène à basses températures a un impact notable sur la vie dans les océans. Par exemple, la densité d'espèces vivantes est plus importante dans les eaux polaires en raison de la plus forte concentration d'oxygène[26]. Les eaux polluées contenant des nutriments pour les plantes comme des nitrates ou des phosphates peuvent stimuler la pousse d'algues par un processus appelé eutrophisation et la décomposition de ces organismes et d'autres biomatériaux peut réduire la quantité de dioxygène dans les eaux eutrophes. Les scientifiques évaluent cet aspect de la qualité de l'eau en mesurant la demande biologique en oxygène de l'eau ou la quantité d'oxygène nécessaire pour revenir à une concentration normale d'O2[20].
Corps simple |
Structure |
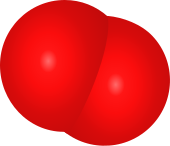
Modèle moléculaire compact du dioxygène.
Dans les conditions normales de température et de pression, l'oxygène est sous forme de gaz inodore et incolore, le dioxygène, de formule chimique O2. Au sein de cette molécule, les deux atomes d'oxygène sont liés chimiquement l'un à l'autre dans un état triplet. Cette liaison, ayant un ordre de 2, est souvent représentée de manière simplifiée par une liaison double[27] ou par l'association d'une liaison à deux électrons et de deux liaisons à trois électrons. L'état triplet de l'oxygène est l'état fondamental de la molécule de dioxygène[28]. La configuration électronique de la molécule présente deux électrons non appariés occupant deux orbitales moléculaires dégénérées [b]. Ces orbitales sont dites antiliantes et font baisser l'ordre de liaison de trois à deux si bien que la liaison du dioxygène est plus faible que la triple liaison du diazote pour lequel toutes les orbitales atomiques liantes sont remplies mais plusieurs orbitales antiliantes ne le sont pas[29].
Dans son état triplet normal, la molécule de dioxygène est paramagnétique, c'est-à-dire qu'elle acquiert une aimantation sous l'effet d'un champ magnétique. Cela est dû au moment magnétique de spin des électrons non appariés de la molécule ainsi qu'à l'interaction d'échange négative entre les molécules voisines de O2[20]. L'oxygène liquide peut être attiré par un aimant si bien que dans des expériences en laboratoire, de l'oxygène liquide peut être maintenu en équilibre contre son propre poids entre les deux pôles d'un aimant puissant[30],[c].
L'oxygène singulet est le nom donné à plusieurs espèces excitées de la molécule de dioxygène dans laquelle tous les spins sont appariés. Dans la nature, il se forme communément à partir de l'eau, durant la photosynthèse, en utilisant l'énergie des rayons solaires[31]. Il est également produit dans la troposphère grâce à la photolyse de l'ozone par des rayons lumineux de courte longueur d'onde[32] et par le système immunitaire comme une source d'oxygène actif[33]. Les caroténoïdes des organismes photosynthétiques (mais aussi parfois des animaux) jouent un rôle majeur dans l'absorption d'énergie à partir de l'oxygène singulet et dans la conversion de celui-ci vers son état fondamental désexcité avant qu'il ne nuise aux tissus[34].
L'oxygène est très électronégatif. Il forme facilement de nombreux composés ioniques avec les métaux (oxydes, hydroxydes). Il forme aussi des composés ionocovalents avec les non-métaux (exemples : le dioxyde de carbone, le trioxyde de soufre) et entre dans la composition de nombreuses classes de molécules organiques, par exemple, les alcools (R-OH), les carbonylés R-CHO ou R2CO et les acides carboxyliques (R-COOH).
Énergie de dissociation des molécules diatomiques O-X à 25 °C en kJ/mol (D298o{displaystyle D_{298}^{o}})[35] :
H 429,91 | He | |||||||||||||||||
Li 340,5 | Be 437 | | B 809 | C 1 076,38 | N 631,62 | O 498,36 | F 220 | Ne | ||||||||||
Na 270 | Mg 358,2 | Al 501,9 | Si 799,6 | P 589 | S 517,9 | Cl 267,47 | Ar | |||||||||||
K 271,5 | Ca 383,3 | | Sc 671,4 | Ti 666,5 | V 637 | Cr 461 | Mn 362 | Fe 407 | Co 397,4 | Ni 366 | Cu 287,4 | Zn 250 | Ga 374 | Ge 657,5 | As 484 | Se 429,7 | Br 237,6 | Kr 8 |
Rb 276 | Sr 426,3 | | Y 714,1 | Zr 766,1 | Nb 726,5 | Mo 502 | Tc 548 | Ru 528 | Rh 405 | Pd 238,1 | Ag 221 | Cd 236 | In 346 | Sn 528 | Sb 434 | Te 377 | I 233,4 | Xe 36,4 |
Cs 293 | Ba 562 | * | Lu 669 | Hf 801 | Ta 839 | W 720 | Re 627 | Os 575 | Ir 414 | Pt 418,6 | Au 223 | Hg 269 | Tl 213 | Pb 382,4 | Bi 337,2 | Po | At | Rn |
Fr | Ra | ** | Lr 665 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| | ↓ | | ||||||||||||||||
| | * | La 798 | Ce 790 | Pr 740 | Nd 703 | Pm | Sm 573 | Eu 473 | Gd 715 | Tb 694 | Dy 615 | Ho 606 | Er 606 | Tm 514 | Yb 387,7 | |||
| | ** | Ac 794 | Th 877 | Pa 792 | U 755 | Np 731 | Pu 656,1 | Am 553 | Cm 732 | Bk 598 | Cf 498 | Es 460 | Fm 443 | Md 418 | No 268 | |||
Allotropes |
L'allotrope ordinaire de l'oxygène sur Terre est nommé dioxygène de formule chimique O2. Il présente une longueur de liaison de 121 pm et une énergie de liaison de 498 kJ mol−1[36]. Il s'agit de la forme utilisée par les formes de vie les plus complexes, comme les animaux, lors de la respiration cellulaire et la forme qui constitue la majeure partie de l'atmosphère terrestre.
Le trioxygène O3, habituellement nommé ozone, est un allotrope très réactif de l'oxygène qui est néfaste pour le tissu pulmonaire[37]. L'ozone est un gaz métastable produit dans les hautes couches de l'atmosphère quand le dioxygène se combine à l'oxygène atomique provenant lui-même de la fragmentation du dioxygène par les rayons ultraviolets[38]. Comme l'ozone absorbe fortement dans le domaine des ultraviolets du spectre électromagnétique, la couche d'ozone contribue à la filtration des ultraviolets qui frappent la Terre[38]. Toutefois, près de la surface de la Terre, c'est un polluant produit par la décomposition lors de journées chaudes des oxydes d'azote issus de la combustion des carburants fossiles sous l'effet des rayons solaires ultraviolets[37],[39]. Depuis les années 1970, la concentration d'ozone dans l'air au niveau du sol augmente du fait des activités humaines[40].
La molécule métastable nommée tétraoxygène (O4) a été découverte en 2001[41],[42] et était jusqu'alors supposée exister dans l'une des six phases de l'oxygène solide. Il est prouvé en 2006 que cette phase, obtenue en pressurisant du dioxygène à 20 GPa est en fait constituée d'un cluster rhomboédrique O8[43]. Ce cluster est potentiellement un comburant plus puissant que le dioxygène ou l'ozone et pourrait par conséquent être utilisé dans les propergols pour fusées[41],[42]. Une phase métallique, découverte en 1990, apparaît lorsque l'oxygène solide est soumis à une pression supérieure à 96 GPa et il a été montré en 1998 qu'à des températures très basses, cette phase devenait supraconductrice[44].
Propriétés physiques |

La déviation d'un filet d'oxygène liquide par un champ magnétique illustre sa propriété paramagnétique.
L'oxygène est plus soluble dans l'eau que ne l'est l'azote. L'eau en équilibre avec l'air contient approximativement une molécule de dioxygène dissous pour deux molécules de diazote. Concernant l'atmosphère, le rapport est approximativement d'une molécule de dioxygène pour quatre de diazote. La solubilité de l'oxygène dans l'eau dépend de la température : environ deux fois plus (14,6 mg L−1) en est dissous à 0 °C qu'à 20 °C (7,6 mg L−1)[20],[45]. À 25 °C et à une pression d'air valant 1 atmosphère, l'eau douce contient environ 6,04 mL d'oxygène par litre alors que l'eau de mer en contient environ 4,95 mL par litre[46]. À 5 °C la solubilité augmente à 9,0 mL par litre d'eau douce soit 50 % de plus qu'à 25 °C et à 7,2 mL par litre d'eau de mer soit 45 % de plus.
L'oxygène se condense à 90,20 K (−182,95 °C) et se solidifie à 54,36 K (−218,79 °C)[47]. Les phases liquide et solide du dioxygène sont toutes deux transparentes avec une légère coloration rappelant la couleur bleue du ciel causée par l'absorption dans le rouge[d]. L'oxygène liquide de haute pureté est habituellement obtenu par distillation fractionnée d'air liquide[48]. L'oxygène liquide peut aussi être produit par condensation d'air en utilisant l'azote liquide comme liquide de refroidissement. C'est une substance extrêmement réactive qui doit rester éloignée de matériaux combustibles[49].
Bien que l'oxygène 17 soit stable, l'oxygène, composé essentiellement d'oxygène 16, présente une section efficace de capture des neutrons thermiques particulièrement basse = 0,267 mb (en moyenne pondérée sur les 3 isotopes stables), ce qui permet son usage dans les réacteurs nucléaires en tant qu'oxyde dans le combustible et dans l'eau en tant que réfrigérant et modérateur.
Néanmoins, l'activation de l'oxygène par les neutrons du cœur provoque la formation d'azote 16 émetteur d'une radiation gamma spécialement énergétique (= 10,419 MeV), mais dont la période n'est que de 7,13 s, ce qui fait que ce rayonnement s'éteint rapidement après arrêt du réacteur.
Historique |
Premières expériences |

John Mayow est l'un des premiers à mener des recherches sur la respiration et l'air.
L'une des premières expériences connues concernant la relation entre la combustion et l'air est menée par Philon de Byzance, écrivain grec du IIe siècle av. J.-C. Dans son ouvrage intitulé Pneumatiques, Philon observe qu'en faisant brûler une bougie dans un récipient renversé dont l'ouverture est plongée dans l'eau, cela provoque une élévation de l'eau dans le col du récipient contenant la bougie[50]. Philon émet une conjecture incorrecte, affirmant qu'une partie de l'air dans le récipient s'est transformée en l'un des quatre éléments, le feu, qui a pu s'échapper du récipient à cause de la porosité du verre. De nombreux siècles plus tard, Léonard de Vinci s'appuie sur le travail de Philon de Byzance et observe qu'une partie de l'air est consumée pendant la combustion et la respiration[21].
L'expérience de la bougie réalisée par Philon de Byzance est l'une des premières à mettre en évidence l'existence du dioxygène.
À la fin du XVIIe siècle, Robert Boyle prouve que l'air est nécessaire à la combustion. Le chimiste anglais John Mayow affine le travail de Boyle en montrant que la combustion a seulement besoin d'une partie de l'air qu'il nomme spiritus nitroaereus ou simplement nitroaereus[51]. Dans une expérience, il constate que lorsqu'il place une souris ou une bougie allumée dans un récipient fermé dont l'ouverture est plongée dans l'eau, le niveau de l'eau augmente dans le récipient et remplace un quatorzième du volume de l'air avant l'extinction des sujets[52]. Dès lors, il conjecture que le nitroaereus est consommé aussi bien par la combustion que par la respiration.
Mayow observe que l'antimoine augmente en masse lorsqu'il est chauffé et en déduit que le nitroaereus doit y être associé[51]. Il pense aussi que les poumons séparent le nitroaereus de l'air et le font passer dans le sang et que la chaleur animale et les mouvements musculaires résultent de la réaction du nitroaereus avec certaines substances du corps[51]. Les comptes-rendus de ces expériences, d'autres expériences et des idées de Mayow sont publiées en 1668 dans Tractatus duo extrait de De respiratione[52].
Phlogistique |

Stahl développa et popularisa la théorie du phlogistique.
Robert Hooke, Ole Borch, Mikhail Lomonosov et Pierre Bayen parviennent tous à produire de l'oxygène dans des expériences aux XVIIe siècle et XVIIIe siècle mais aucun d'entre eux ne le reconnaît comme élément chimique[20]. Cela est probablement dû en partie à la théorie scientifique concernant la combustion et la corrosion et nommée phlogisitique qui était alors l'explication la plus répandue pour expliquer ces phénomènes[53].
Établie en 1667 par le chimiste allemand Johann Joachim Becher et modifiée par le chimiste Georg Ernst Stahl en 1731[54], la théorie du phlogistique affirme que tous les matériaux combustibles sont constitués de deux parties : une partie nommée phlogiston qui s'échappe lorsque la substance qui le contient brûle tandis que la partie déphlogistiquée constitue la vraie forme de la substance[21].
Les matériaux hautement combustibles qui laissent très peu de résidus comme le bois ou le charbon sont considérés comme contenant majoritairement du phlogiston alors que les substances non combustibles qui se corrodent comme le métal, en contiennent très peu. L'air ne joue aucun rôle dans la théorie du phlogistique, pas plus que les premières expériences menées à l'origine pour en tester l'idée. Au contraire, la théorie se base sur l'observation de ce qui se produit lorsqu'un objet brûle et sur le fait que la majorité des objets apparaît plus léger et semble avoir perdu quelque chose pendant le processus de combustion[21]. Pour justifier le fait qu'un matériau comme du bois voit en fait sa masse augmenter en brûlant, Stahl affirme que le phlogiston a une masse négative[55]. En effet, le fait que les métaux voient eux aussi leur masse augmenter en rouillant alors qu'ils sont supposés perdre du phlogiston est l'un des premiers indices infirmant la théorie du phlogistique.
Découverte |
L'oxygène est découvert en premier par le chimiste suédois Carl Wilhelm Scheele. Il produit du dioxygène en chauffant de l'oxyde de mercure et divers nitrates vers 1772[21]. Scheele nomme ce gaz « Feuerluft » (air de feu)[56] car c'est le seul comburant connu et écrit un compte-rendu de sa découverte dans un manuscrit qu'il intitule Traité chimique de l'air et du feu qu'il envoie à son éditeur en 1775 mais qui ne sera pas publié avant 1777[20].

C'est à Joseph Priestley qu'on attribue généralement la découverte de l'oxygène.
Dans le même temps, le 1er août 1774, une expérience conduit le pasteur britannique Joseph Priestley à faire converger les rayons du Soleil vers un tube en verre contenant de l'oxyde de mercure (HgO). Cela provoque la libération d'un gaz qu'il nomme « air déphlogistiqué »[20]. Il constate que la flamme des bougies est plus brillante dans ce gaz et qu'une souris est plus active et vit plus longtemps en le respirant. Après avoir lui-même respiré le gaz il écrit : « la sensation de [ce gaz] dans mes poumons n'était pas sensiblement différente de celle de l'air ordinaire mais j’eus l'impression que ma respiration était particulièrement légère et facile pendant un certain temps par la suite »[20]. Priestley publie ses découvertes en 1775 dans un article intitulé An Account of Further Discoveries in Air inclus dans le second volume de son livre, Experiments and Observations on Different Kinds of Air[21],[57].
Le chimiste français Antoine Laurent Lavoisier déclare plus tard avoir découvert cette nouvelle substance indépendamment de Priestley. Toutefois, Priestley rend visite à Lavoisier en octobre 1774, lui parle de son expérience et de la façon dont il a libéré le gaz. Scheele envoie également une lettre à Lavoisier le 30 septembre 1774 dans laquelle il décrit sa propre découverte de la substance jusqu'alors inconnue mais Lavoisier déclare ne jamais l'avoir reçu (une copie de la lettre est retrouvée dans les affaires de Scheele après sa mort)[20].
Contribution de Lavoisier |
Même si cela est contesté à son époque, la contribution de Lavoisier est incontestablement d'avoir réalisé les premières expériences quantitatives satisfaisantes sur l'oxydation et d'avoir donné la première explication correcte sur la façon dont se déroule une combustion[21]. Ses expériences, toutes commencées en 1774, conduiront à discréditer la théorie du phlogistique et prouver que la substance découverte par Priestley et Scheele est un élément chimique[58].
Dans une expérience, Lavoisier observe qu'il n'y a généralement pas d'augmentation de masse quand l'étain et l'air sont chauffés dans une enceinte fermée[21]. Il remarque que l'air ambiant s'engouffre dans l'enceinte lorsqu'il l'ouvre ce qui prouve qu'une partie de l'air emprisonné a été consommée. Il constate également que la masse de l'étain a augmenté et que cette augmentation correspond à la même masse d'air qui s'est engouffrée dans l'enceinte lors de son ouverture. D'autres expériences ainsi que celle-ci sont détaillées dans son livre Sur la combustion en général, publié en 1777[21]. Dans cette œuvre, il prouve que l'air est un mélange de deux gaz : l'« air vital » qui est essentiel à la respiration et la combustion et l'azote (du grec ἄζωτον, « privé de vie ») qui leur est inutile[21].
Lavoisier renomme l'« air vital » en oxygène en 1777 à partir de la racine grecque ὀξύς (oxys) (acide, littéralement "âpre" d'après le goût des acides et -γενής (-genēs) (producteur, littéralement « qui engendre ») car il croit à tort que l'oxygène est un constituant de tous les acides[38]. Des chimistes, notamment Sir Humphry Davy en 1812, prouvent finalement que Lavoisier s'était trompé à cet égard (c'est en réalité l'hydrogène qui est à la base de la chimie des acides) mais le nom est resté.
Histoire récente |
La théorie atomique de John Dalton suppose que tous les éléments sont monoatomiques et que les atomes dans les corps composés sont dans des rapports simples. Par exemple, Dalton suppose que la formule chimique de l'eau est HO, donnant à l'oxygène une masse atomique huit fois supérieure à celle de l'hydrogène contrairement à la valeur actuelle qui vaut environ seize fois celle de l'hydrogène[59]. En 1805, Joseph Louis Gay-Lussac et Alexander von Humboldt montrent que l'eau est formée de deux volumes d'hydrogène et d'un volume d'oxygène et en 1811 Amedeo Avogadro parvient à interpréter correctement la composition de l'eau sur la base de ce qu'on appelle maintenant la loi d'Avogadro et l'hypothèse des molécules diatomiques élémentaires[60],[e].
À la fin du XIXe siècle, des scientifiques réalisent que l'air peut être liquéfié et ses composants isolés en le compressant et le refroidissant. Utilisant un processus en cascade, le chimiste et physicien suisse Raoul Pictet fait évaporer du dioxyde de soufre liquide afin de liquéfier du dioxyde de carbone qui, à son tour, s'évapore pour refroidir suffisamment du dioxygène, permettant ainsi de le liquéfier. Le 22 décembre 1877, il envoie un télégramme à l'Académie des sciences à Paris dans lequel il annonce sa découverte de l'oxygène liquide[61]. Deux jours après, le physicien français Louis Paul Cailletet décrit sa propre méthode de liquéfaction de l'oxygène[61]. Dans les deux cas, seules quelques gouttes de liquide sont produites donc il est impossible de mener des analyses approfondies. L'oxygène est liquéfié dans un état stable pour la première fois le 29 mars 1883 par le scientifique polonais Zygmunt Wróblewski de l'université jagellonne de Cracovie et par Karol Olszewski[62].
En 1891, le chimiste écossais James Dewar est capable de produire suffisamment d'oxygène liquide pour pouvoir l'étudier[20]. Le premier processus commercialement viable pour produire de l'oxygène liquide est développé en 1895 indépendamment par l'ingénieur allemand Carl von Linde et l'ingénieur anglais William Hampson. Dans les deux procédés, la température de l'air est abaissée jusqu'à ce que l'air soit liquéfié puis les différents composés gazeux sont distillés en les faisant bouillir les uns après les autres et en les capturant[63]. Plus tard, en 1901, le soudage oxyacétylénique est présenté pour la première fois en brûlant un mélange d'acétylène et de dioxygène comprimé. Cette méthode de soudure et de coupure du métal est devenue courante par la suite[63]. En 1902, Georges Claude imagine un procédé de liquéfaction de l'air qui améliore le rendement de celui imaginé par Linde et où le travail fourni par la détente adiabatique de l'air après sa compression est utilisé dans le compresseur. Le refroidissement qui l'accompagne (effet Joule-Thomson) est mis à profit dans un échangeur de chaleur qui refroidit l'air à la sortie du compresseur. Claude réalise ainsi la séparation par distillation fractionnée de l'oxygène, de l'azote, de l'argon.
En 1923, le scientifique américain Robert H. Goddard est le premier à développer un moteur-fusée utilisant du carburant liquide. Le moteur utilise de l'essence comme carburant et de l'oxygène liquide comme comburant. Goddard fait voler avec succès une petite fusée à carburant liquide. Il lui fait atteindre 56 m et 97 km/h le 16 mars 1926 à Auburn (Massachusetts)[63],[64].
Notes et références |
(en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Oxygen » (voir la liste des auteurs).
Notes |
Les chiffres ci-contre sont valables pour des altitudes allant jusqu'à 80 km au-dessus de la surface terrestre.
L'orbitale est un concept issu de la mécanique quantique qui modélise l'électron comme une particule ondulatoire ayant une distribution spatiale autour d'un atome ou d'une molécule.
Le paramagnétisme de l'oxygène est une propriété servant dans les analyseurs d'oxygène paramagnétiques qui déterminent la pureté de l'oxygène gazeux((en) « Company literature of Oxygen analyzers (triplet) », Servomex (consulté le 15 juin 2013)).
La couleur du ciel est due quant à elle à la diffusion Rayleigh de la lumière bleue.
Cependant, ces résultats sont la plupart du temps ignorés jusqu'en 1860. L'une des raisons de ce rejet repose sur la croyance que les atomes d'un élément ne peuvent pas avoir d'affinité chimique avec un autre atome du même élément. Par ailleurs, les exceptions apparentes à loi d'Avogadro qui ne sont expliquées que plus tard par le phénomène de dissociation des molécules constituent une autre raison.
Références |
(en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
(en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, 2008, p. 2832 - 2838 (DOI 10.1039/b801115j)
Paul Arnaud, Brigitte Jamart, Jacques Bodiguel, Nicolas Brosse, Chimie Organique 1er cycle/Licence, PCEM, Pharmacie, Cours, QCM et applications, Dunod, 8 juillet 2004, 710 p., Broché (ISBN 2100070355)
(en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, 2006, 87e éd. (ISBN 0849304873), p. 10-202
encyclopedia.airliquide.com
Entrée de « Oxygen » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21 août 2018 (JavaScript nécessaire)
Lavoisier A. (1789). Traité élémentaire de chimie, 1864, p. 48.
Oxygène
(en) Jin Xiong, William M. Fischer, Kazuhito Inoue, Masaaki Nakahara, Carl E. Bauer, « Molecular Evidence for the Early Evolution of Photosynthesis », Science, vol. 289, no 5485, 8 septembre 2000, p. 1724-1730 (ISSN 1095-9203, DOI 10.1126/science.289.5485.1724, lire en ligne)
Jacques Le Coarer, Chimie, le minimum à savoir, Edp Sciences, juin 2003, 184 p. (ISBN 2868836364), p. 59
(en) « Oxygen Nuclides / Isotopes », sur EnvironmentalChemistry.com (consulté le 22 juin 2013)
(en) B.S. Meyer (19-21 septembre 2005). « Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen » dans Workgroup on Oxygen in the Earliest Solar System Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute.
(en) « Nuclear structure of Oxygen 12 », Université de Szeged (consulté le 22 juin 2013)
(en) « NUDAT 13O » (consulté le 22 juin 2013)
(en) « NUDAT 14O » (consulté le 22 juin 2013)
(en) « NUDAT 15O » (consulté le 22 juin 2013)
Gerbaud, A., André, M., 1979. Photosynthesis and photorespiration in whole plants of wheat. Plant. Physiol. 64, 735-738.
Gerbaud, A., André, M., 1980. Effect of CO2, O2, and light on photosynthesis and photorespiration in wheat. Plant Physiol. 66, 1032-1036
(en) Ken Croswell, Alchemy of the Heavens, Anchor, février 1996(ISBN 0-385-47214-5, lire en ligne)
(en) John Emsley, Nature's Building Blocks: An A-Z Guide to the Elements, Oxford, Angleterre, Oxford University Press, 2001(ISBN 0-19-850340-7), p. 297-304
(en) Gerhard A. Cook et Carol M. Lauer, « Oxygen », dans The Encyclopedia of the Chemical Elements, New York, Reinhold Book Corporation, 1968(LCCN 68-29938), p. 499-512
(en) « Oxygen », Los Alamos National Laboratory (consulté le 22 juin 2013)
Jérôme Morlon, « Pourquoi... l'atmosphère contient-elle 21% d'oxygène ? », L'Internaute, décembre 2005(consulté le 23 juin 2013)
(en) « Nutrient Cycles », Département de biologie de l'Université de Hambourg (consulté le 23 juin 2013)
Michel Verdaguer, « Oxygène », Union des professeurs de physique et de chimie (consulté le 23 juin 2013)
D'après The Chemistry and Fertility of Sea Waters de H.W. Harvey, 1955, citant C.J.J. Fox, "On the coefficients of absorption of atmospheric gases in sea water", Publ. Circ. Cons. Explor. Mer, no 41, 1907. Harvey note cependant que d'après de récents articles de Nature, les valeurs semblent être trop élevées de 3%
(en) « Molecular Orbital Theory », Purdue University (consulté le 9 juin 2013)
(en) L. Pauling, The nature of the chemical bond and the structure of molecules and crystals : an introduction to modern structural chemistry, Ithaca, N.Y., Cornell University Press, 1960, 3e éd. (ISBN 0-8014-0333-2)
(en) Henry Jokubowski, « Biochemistry Online », Saint John's University (consulté le 9 juin 2013), Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen
(en) « Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet », University of Wisconsin-Madison Chemistry Department (consulté le 14 juin 2013)
(en) Anja Krieger-Liszkay, « Singlet oxygen production in photosynthesis », Journal of Experimental Botanics, Oxford Journals, vol. 56, no 411, 13 octobre 2004, p. 337-346 (PMID 15310815, DOI 10.1093/jxb/erh237)
(en) Roy M. Harrison, Pollution: Causes, Effects & Control, Cambridge, Royal Society of Chemistry, 1990, 2e éd. (ISBN 0-85186-283-7)
(en) Paul Wentworth, JE McDunn, AD Wentworth, C Takeuchi, J Nieva, T Jones, C Bautista, JM Ruedi et A Gutierrez, « Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation », Science, vol. 298, no 5601, 13 décembre 2012, p. 215-219 (PMID 12434011, DOI 10.1126/science.1077642Jr., Bibcode 2002Sci...298.2195W)
(en) Osamu Hirayama et al., « Singlet oxygen quenching ability of naturally occurring carotenoids », Lipids, Springer, vol. 29, no 2, 1994, p. 149-150 (PMID 8152349, DOI 10.1007/BF02537155)
(en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
(en) Chung Chieh, « Bond Lengths and Energies », University of Waterloo (consulté le 15 juin 2013)
(en) Albert Stwertka, Guide to the Elements, Oxford University Press, 1998(ISBN 0-19-508083-1), p. 48-49
(en) G. D. Parks et J. W. Mellor, Mellor's Modern Inorganic Chemistry, Londres, Longmans, Green and Co, 1939, 6e éd.
« Le climat de la Terre », CNRS (consulté le 15 juin 2013)
Sylvestre Huet, « L'ozone du ciel et l'ozone des villes », Libération, 19 août 1997(consulté le 15 juin 2013)
(en) Fulvio Cacace, Giulia de Petris et Anna Troiani, « Experimental Detection of Tetraoxygen », Angewandte Chemie International Edition, vol. 40, no 21, 2001, p. 4062-65 (PMID 12404493, DOI 10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X)
(en) Phillip Ball, « New form of oxygen found », Nature News, 16 septembre 2001(consulté le 15 juin 2013)
(en) Lars F. Lundegaard, Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers et Paul Loubeyre, « Observation of an O8 molecular lattice in the phase of solid oxygen », Nature, vol. 443, no 7108, 2006, p. 201-04 (PMID 16971946, DOI 10.1038/nature05174, lire en ligne)
(en) K. Shimizu, K. Suhara, M. Ikumo, M.I. Eremets et K. Amaya, « Superconductivity in oxygen », Nature, vol. 393, no 6687, 1998, p. 767-69 (DOI 10.1038/31656)
(en) « Air solubility in water », The Engineering Toolbox (consulté le 16 juin 2013)
(en) David Hudson Evans et James B. Claiborne, The Physiology of Fishes, CRC Press, 2006(ISBN 0-8493-2022-4), p. 88
(en) David R. Lide, « Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements », dans David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, Floride, CRC Press, 2003(ISBN 0-8493-0595-0)
(en) « Overview of Cryogenic Air Separation and Liquefier Systems », Universal Industrial Gases, Inc. (consulté le 16 juin 2013)
(en) « Liquid Oxygen Material Safety Data Sheet », Matheson Tri Gas (consulté le 16 juin 2013)
(en) Joseph Jastrow, Story of Human Error, Ayer Publishing, 1936(ISBN 0-8369-0568-7, lire en ligne), p. 171
(en) « John Mayow », dans Encyclopaedia Britannica, 1911, 11e éd. (lire en ligne)
(en) « John Mayow », dans World of Chemistry, Thomson Gale, 2005(ISBN 0-669-32727-1)
(en) « Oxygen », sur http://www.webelements.com (consulté le 30 juin 2013)
(en) Richard Morris, The last sorcerers: The path from alchemy to the periodic table, Washington, D.C., Joseph Henry Press, 2003(ISBN 0-309-08905-0)
« Lavoisier, le parcours d'un scientifique révolutionnaire », CNRS (consulté le 30 juin 2013)
Bernadette Bensaude-Vincent et Isabelle Stengers, Histoire de la chimie, Paris, Syros, 2001(ISBN 9782707135414)
(en) Joseph Priestley, « An Account of Further Discoveries in Air », Philosophical Transactions, vol. 65, 1775, p. 384-94 (DOI 10.1098/rstl.1775.0039)
« Antoine Laurent Lavoisier », Musée national des douanes (consulté le 1er juillet 2013)
(en) Dennis DeTurck, Larry Gladney et Anthony Pietrovito, « Do We Take Atoms for Granted? », sur http://www.physics.upenn.edu, University of Pennsylvania, 1997(consulté le 1er juillet 2013)
(en) Henry Enfield Roscoe et Carl Schorlemmer, A Treatise on Chemistry, D. Appleton and Co., 1883, p. 38
(en) John Daintith, Biographical Encyclopedia of Scientists, CRC Press, 1994(ISBN 0-7503-0287-9), p. 707
(en) « Poland – Culture, Science and Media. Condensation of oxygen and nitrogen », sur http://www.poland.gov.pl (consulté le 1er juillet 2013)
(en) « Oxygen », dans How Products are Made, The Gale Group, Inc, 2002
(en) « Goddard-1926 », NASA (consulté le 1er juillet 2013)
Voir aussi |
.mw-parser-output .autres-projets ul{margin:0;padding:0}.mw-parser-output .autres-projets li{list-style-type:none;list-style-image:none;margin:0.2em 0;text-indent:0;padding-left:24px;min-height:20px;text-align:left}.mw-parser-output .autres-projets .titre{text-align:center;margin:0.2em 0}.mw-parser-output .autres-projets li a{font-style:italic}
Bibliographie |
- Histoire de l'oxygène. De l'alchimie à la chimie
Articles connexes |
- Oxygène 18
- Combustion
- Grande Oxydation
- Macro-élément
- Médecine hyperbare
- Oxyduc
- Oxygénothérapie normobare
- Réaction d'oxydo-réduction
- Stades isotopiques de l'oxygène
Liens externes |
(en) « Technical data for Oxygen » (consulté le 23 avril 2016), avec en sous-pages les données connues pour chaque isotope- Priestley, Scheele, Lavoisier. De l'air déphlogistiqué à l'air du feu et à l'oxygène.
| | 1 | 2 | | | | | | | | | | | | | | | | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
1 | H | | | He | |||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | ||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
6 | Cs | Ba | | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
7 | Fr | Ra | | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
8 | 119 | 120 | * | | | ||||||||||||||||||||||||||||
| | * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | | |||||||||
Métaux Alcalins | Alcalino- terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métal- loïdes | Non- métaux | Halo- gènes | Gaz nobles | Éléments non classés |
Actinides | |||||||||
| | Superactinides | | |||||||
- Portail de la chimie
