Protoxyde d'azote
| Protoxyde d'azote | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 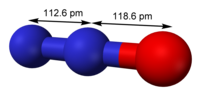 Structure du protoxyde d'azote. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Nom UICPA | protoxyde d'azote | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Synonymes | oxyde nitreux | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NoECHA | 100.030.017 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No CE | 233-032-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No RTECS | QX1350000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code ATC | N01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 17045 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No E | E942 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
FEMA | 2779 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
SMILES | [O-][N+]#N , | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
InChI | InChI : InChI=1/N2O/c1-2-3 Std. InChI : InChI=1S/N2O/c1-2-3 Std. InChIKey : GQPLMRYTRLFLPF-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | gaz comprimé liquéfié incolore, d'odeur caractéristique[1]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Formule brute | N2O [Isomères] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Masse molaire[3] | 44,0128 ± 0,0007 g/mol N 63,65 %, O 36,35 %, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Moment dipolaire | 0,160 83 D[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
T° fusion | −90,8 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
T° ébullition | −88,5 °C[1] Décomposition à 300 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Solubilité | 1,5 g·l-1 (eau, 15 °C)[1]. Soluble aussi dans l'acide sulfurique, l'éthanol, l'éther, les huiles. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Masse volumique | 1,23 g cm−3 (liquide, −89 °C)[1] 0,0018 g cm−3 (gaz) équation[4] : ρ=2.781/0.27244(1+(1−T/309.57)0.2882){displaystyle rho =2.781/0.27244^{(1+(1-T/309.57)^{0.2882})}}
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Pression de vapeur saturante | 51,7 bar à 21 °C équation[4] : Pvs=exp(96.512+−4045T+(−12.277)×ln(T)+(2.8860E−5)×T2){displaystyle P_{vs}=exp(96.512+{frac {-4045}{T}}+(-12.277)times ln(T)+(2.8860E-5)times T^{2})}
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Point critique | 72,7 bar, 36,55 °C[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vitesse du son | 263 m·s-1 (0 °C, 1 atm)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
S0gaz, 1 bar | 219,96 J mol−1 K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ΔfH0gaz | 82,05 kJ mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ΔvapH° | 16,53 kJ·mol-1 (1 atm, −88,48 °C)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cp | équation[4] : CP=(6.7556E4)+(54.373)×T{displaystyle C_{P}=(6.7556E4)+(54.373)times T}
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
PCS | 82,1 kJ·mol-1 (25 °C, gaz)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés électroniques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1re énergie d'ionisation | 12,886 eV (gaz)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
SGH[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Danger H270, H280, P370, P376, P403, H270 : Peut provoquer ou aggraver un incendie ; comburant H280 : Contient un gaz sous pression ; peut exploser sous l'effet de la chaleur P370 : En cas d’incendie : P376 : Obturer la fuite si cela peut se faire sans danger. P403 : Stocker dans un endroit bien ventilé. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
SIMDUT[11] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, C, D2A, A : Gaz comprimé température critique = 36,4 °C C : Matière comburante cause ou favorise la combustion d'une autre matière en dégageant de l'oxygène D2A : Matière très toxique ayant d'autres effets toxiques tératogénicité chez l'animal ; embryotoxicité chez l'animal Divulgation à 0,1 % selon la liste de divulgation des ingrédients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
0 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Transport[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 25 : gaz comburant (favorise l'incendie) Numéro ONU : 1070 : PROTOXYDE D’AZOTE Classe : 2.2 Étiquettes :  2.2 : Gaz ininflammables, non toxiques (correspond aux groupes désignés par un A ou un O majuscule);  5.1 : Matières comburantes
Code Kemler : 225 : gaz liquéfié réfrigéré, comburant (favorise l'incendie) Numéro ONU : 2201 : PROTOXYDE D’AZOTE LIQUIDE RÉFRIGÉRÉ Classe : 2.2 Étiquettes :  2.2 : Gaz ininflammables, non toxiques (correspond aux groupes désignés par un A ou un O majuscule);  5.1 : Matières comburantes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Inhalation | Asphyxiant si inhalé pur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Peau | Toxique si cryogénique ou compressé | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Yeux | Toxique si cryogénique ou compressé | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Données pharmacocinétiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CAM | 105 % vol. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Métabolisme | Nul | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Considérations thérapeutiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe thérapeutique | Anesthésique général, analgésique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Voie d’administration | Inhalatoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Caractère psychotrope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Catégorie | Hallucinogène dissociatif | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mode de consommation | Inhalatoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Autres dénominations | Gaz hilarant | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risque de dépendance | Faible | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le protoxyde d'azote, également appelé oxyde nitreux, hémioxyde d'azote ou encore gaz hilarant, est un composé chimique de formule N2O.
C'est un gaz incolore, à l'odeur et au goût légèrement sucrés. Il est utilisé en anesthésie, chirurgie, odontologie et comme adjuvant en mélange équimolaire avec de l'oxygène, pour ses propriétés anesthésiques et analgésiques. On l'appelle « gaz hilarant » en raison de son effet euphorisant à l'inhalation, d'où son usage récréatif comme hallucinogène. Il est également utilisé comme comburant pour accroître la puissance des moteurs en compétition automobile, ainsi qu'avec l'acétylène H-C≡C-H pour certains appareils d'analyse (spectrométrie d'absorption atomique[12]). Présent à l'état de traces dans l'atmosphère (329 ppb), c'est un puissant gaz à effet de serre (298 fois plus puissant que le CO2) et il contribue à la destruction de la couche d'ozone. Ses émissions sont d'origine naturelle et humaine.
Sommaire
1 Propriétés chimiques
1.1 Production et synthèse
1.2 Réactivité
2 Historique
3 Sources
3.1 Sources naturelles
3.2 Sources humaines
4 Contribution à l'effet de serre
5 Gaz destructeur de la couche d'ozone
6 Utilisations
6.1 Usage médical
6.2 Usage dans les moteurs à combustion interne
6.2.1 Principe
6.2.2 Aviation
6.2.3 Compétition automobile
6.3 Usage dit « récréatif »
6.4 Autres usages
7 Toxicologie
7.1 Effets et conséquences, toxicité
7.1.1 Effets de doses importantes à court terme
7.1.2 Effets de doses importantes à long terme
8 Notes et références
9 Voir aussi
9.1 Article connexe
9.2 Liens externes
9.3 Bibliographie
Propriétés chimiques |
Production et synthèse |
Le protoxyde d'azote est préparé par décomposition du nitrate d'ammonium fondu entre 250 °C et 260 °C selon l'équation de réaction suivante[13] :
NH4NO3 → N2O + 2 H2O
Il se forme toujours 1 à 2 % de diazote N2 et du monoxyde d'azote NO. Ce dernier est supprimé par passage sur du sulfate de fer(II). Le nitrate d'ammonium utilisé doit être exempt d'ions chlorure Cl– qui catalysent la formation de N2. Cependant, le chauffage de solutions de nitrate d'ammonium dans l'acide nitrique ou dans l'acide sulfurique conduit à du protoxyde d'azote pur même en présence de petites quantités d'ions chlorure.
Réactivité |
Le protoxyde d'azote est un gaz peu réactif. À température ambiante, il ne réagit pas avec les dihalogènes (Cl2, Br2 ou I2), ni avec les métaux alcalins (Li, Na, K). Il n'est également pas modifié par l'ozone O3 mais contribue à la dégradation de l'ozone stratosphérique (couche d'ozone protectrice de la biosphère contre les UV solaires).
Il peut se fixer sur certains cations métalliques en tant que ligand et forme des complexes comme [Ru(NH3)5(N2O)]2+. Il peut aussi oxyder des métaux de transition à basse valence dans les complexes.
À haute température, il se décompose en diazote et dioxygène :
- 2 N2O → 2 N2 + O2
Il réagit avec de nombreux composés organiques et il dope les combustions grâce à son fort pouvoir oxydant[1].
Historique |
En 1772 Joseph Priestley découvre le protoxyde d'azote[14] et le décrit dans Experiments and Observations on Different Kinds of Air.
En 1798, Humphry Davy découvre entre autres ses propriétés euphorisantes. Le protoxyde d'azote est utilisé dès la fin du XVIIIe siècle comme « gaz hilarant » dans les foires.
En 1844 le dentiste Horace Wells découvre ses effets anesthésiants, qu'il expérimente sur lui-même. Malheureusement, impatient de faire connaître sa découverte, Wells se lance, sans expérimentation approfondie préalable, dans des démonstrations devant un public médical à Hartford (Connecticut) et à Harvard qui furent des échecs retentissants. Dépité, Wells abandonna définitivement la dentisterie. Il faudra attendre les recherches et démonstrations réussies de William Thomas Green Morton avec l'éther (octobre et novembre 1846 à Boston) pour que l'anesthésie soit utilisée par les chirurgiens, ce qui a permis à la chirurgie de faire un bond en avant (la douleur était l'une des deux grandes limites de la chirurgie, avec l'infection). Le Protoxyde d'azote ne fut remis à l'honneur que par un dénommé Colton, montreur de spectacles au gaz hilarant, qui, associé au dentiste J.H. Smith montèrent une clinique à New York puis exportèrent leur procédure en Europe.
En 1961, des médecins anglais l’utilisent pour la première fois en obstétrique où il atténue la douleur et a un rôle d'anxiolyse.
Dans les années 1980, son usage est grandement améliorée par l'association avec de l’oxygène (Le premier risque à son utilisation était et reste l'asphyxie par manque de dioxygène. La médecine l'utilise donc en mélange équimolaire avec du dioxygène (MEOPA).), il remplace alors progressivement l’éther et le chloroforme en obstétrique[15].
En 1998, il a un statut de médicament antalgique.
En novembre 2001, il obtient enfin en France son autorisation de mise sur le marché (AMM), alors qu'il était déjà régulièrement utilisé sous cette forme durant le XXe siècle. Auparavant, il était distribué (hors de la classification médicament comme les autres gaz médicaux) dans la majorité des blocs opératoires et a constitué l'un des agents de l'anesthésie générale durant le XXe siècle ; sa faible puissance anesthésique restreignant son usage à des actes assez peu douloureux, et au rôle d'adjuvant de médicaments plus puissants dont il permet de réduire les doses en diminuant certains effets indésirables.
Fin 2009, en France l’AFSSAPS modifie la réglementation afin que le MEOPA puisse être utilisé hors des établissements hospitaliers[16], régularisant la situation de ceux qui l'utilisaient (en France au moins depuis 1996 « à domicile » chez des patients adultes sidéens pour soulager la douleur d'ulcérations cutanées associées au syndrome de Kaposi et chez certains malades âgés porteurs d’ulcères cutanés ou d’escarres rendus trop somnolents par un traitement antérieur, ou sporadiquement en pédiatrie à domicile, pour soulager des douleurs majeures quand les produits morphiniques ne suffisait plus chez des enfants en soins palliatifs[17]. Il était en outre utilisé ponctuellement par des médecins, par exemple en dermatologie ou en ORL au domicile de patients adultes, puis très régulièrement chez les enfants (annexe 2) sans remboursement par la sécurité sociale car ce moyen antalgique était hors nomenclature).
Des médecins signalent que « la reproductibilité de l'effet n’est pas complète, avec un manque d’efficacité chez certains » ; les principaux effets indésirables sont des nausées et vomissements, « généralement réversibles en quelques minutes à l’arrêt du traitement »[18] (un groupe d'experts[19] réunis par l'AFSSAPS considère dans son rapport[20] que « Le MEOPA ne permet pas de couvrir tous les actes et soins douloureux. Selon les indications, l’âge de l’enfant et l’expérience de l’équipe, 10 à 30 % d’échecs sont observés. Les enfants de moins de 2 ans ont des effets beaucoup moins marqués »[21]).
L’AFSSAPS précise que :
« tout mésusage ou abus doit être prévenu. Dans ce contexte, un reclassement dans la catégorie des médicaments réservés à l’usage professionnel a été retenu ; ce mélange gazeux ne peut donc être distribué qu’aux professionnels de santé concernés et non directement aux patients[15].
La modification des conditions de prescription et de délivrance a entraîné la révision complète des RCP des spécialités concernées. En outre, compte-tenu de l’ensemble des risques liés à l’utilisation des spécialités à base de MEOPA, l’Afssaps conditionne leur mise à disposition en dehors des établissements de santé à la mise en application d’un plan de gestion des risques (PGR) national commun.
Il repose sur un engagement des laboratoires à la mise en place des mesures de gestion et de minimisation des risques suivantes[15] :
- la réalisation d’une surveillance de pharmacovigilance et de pharmacodépendance renforcée avec
- l’incitation des professionnels de santé à notifier les effets indésirables, les cas d’abus, de pharmaco dépendance, d’usage détourné et de mésusages liés à l’utilisation du MEOPA ;
- pendant les deux premières années, la transmission semestrielle à l’Afssaps des rapports périodiques actualisés de Pharmacovigilance accompagnés de la synthèse française des cas rapportés, du bilan des consommations et des conditions d’utilisation du produit ;
- la sécurisation et la traçabilité de la distribution et de la récupération, avec notamment la vérification à la commande de la qualité et de la formation du demandeur ;
- la sécurisation et traçabilité de l’utilisation : volumes des bouteilles limité à 5 L et sécurisation des bouteilles ;
- la réalisation d’un plan de formation des professionnels : médecins, pharmaciens et personnel soignant ;
- la mise à disposition d’un document d’information destiné aux patients (en cas de stockage à domicile.). »
L'année suivante (2010), la réserve hospitalière et ouverte à la dentisterie, l’Afssaps lance un suivi national de pharmacovigilance et de pharmacodépendance du N2O ; en particulier les vols de N2O doivent lui être déclaré[15].
En 2001 (en France), les indications en hospitalisation au domicile pédiatrique ont intégré les trois cas suivants :
- actes médicaux invasifs et répétés, insuffisamment calmés par d’autres moyens antalgiques faibles (Emla, antalgiques palier 1) tels que des injections intramusculaires pour une chimiothérapie, la réfection de pansements sur peau lésée[15] ;
- soins médicaux jugés normalement peu douloureux par les médecins, mais source d’angoisse ou d’anxiété marqués pour un enfant particulier (tels que des pansements de cathéter veineux central, des prélèvements sanguins veineux périphériques itératifs[15] ;
- soins réitérés durant des mois devenant source de difficultés marquées d’acceptation[15].
Sources |
Selon l'OMM (2017), ses émissions sont d'origine naturelle pour environ 60 % et humaine pour environ 40 %[22] alors qu'une estimation antérieure (2009) concluait à 30 % d'origine humaine[23].
Sources naturelles |
Certains micro-organismes du sol et des océans en sont les principales sources naturelles mais il est également produit par la combustion de matières organiques et de combustibles fossiles, l’industrie ou les stations d'épuration des eaux usées[24], etc. Sa production dans les sols et dans l'air à partir des sols est fortement augmentée par la fertilisation azotée (usage des engrais et amendements azotés[25].
Les bactéries vivant dans certaines fourmilières en sont une source importante ; les gaz exhalés par vingt-deux nids de fourmis coupeuses de feuilles (du sud-ouest du Costa Rica) a montré, qu'en contexte humides et pauvre en oxygène, ces bactéries produisent des quantités très importantes de méthane, mais aussi d'oxyde nitreux[26]. Les taux de méthane sont au dessus des monticules environ vingt fois plus importants qu'alentours dans la forêt[26]. L’oxyde nitreux est jusqu'à mille fois plus élevé que le niveau de fond. Ces grandeurs sont comparables à celles observées dans les station d'épuration d'eaux usées et des fosses à lisier[26]. Ces fourmis contribuent néanmoins aussi aux fonctions de puits de carbone du sol ; le bilan de leurs effets globaux sur le climat n'est pas encore évalué faute de données suffisantes[26], mais cette production explique pourquoi les études précédentes avaient mesuré des niveaux très variables de méthane et d’oxyde nitreux dans les forêts et régions où ces fourmis construisent leurs nids souterrains[26].
Une partie des émissions des sols cultivés ou prairiaux ayant fait l'objets d'épandages de fumiers et lisiers, de boues d'épuration ou de certains engrais est en réalité d'origine humaine.
Sources humaines |
Un tiers du N2O de l'atmosphère provient de l'épandage de lisier et d'engrais azotés[réf. nécessaire].
En France, l’agriculture contribue à hauteur de 86 % aux émissions de N2O provenant essentiellement de la transformation des produits azotés (engrais, fumier, lisier, résidus de récolte) épandus sur les terres agricoles. Une petite partie des émissions provient de la pollution routière, en particulier des véhicules équipés de pots catalytiques et de quelques procédés industriels[27],[28].
Contribution à l'effet de serre |

Contributions aux émissions anthropiques de protoxyde d'azote (N2O) en 2005 (sous-secteurs).
Les sources de moindre importance (ex. : eaux usées et aquaculture) figurent dans la barre du bas intitulée « Autres ». Les barres rouges correspondent aux marges d'erreur (rouge)[29]. En 2005, le total (dominé par les émissions agricoles) correspond à 30-40 % environ de tout le N2O introduit annuellement par l'Homme dans l'atmosphère.
Ce gaz est aussi un puissant gaz à effet de serre.
Selon le GIEC[30], son potentiel de réchauffement global à cent ans est égal à 298, c'est-à-dire qu'il contribue 298 fois plus au réchauffement climatique qu'une même masse de CO2 émise en même temps pendant les cent ans qui suivent leur émission.
En 2009, dans un article de la revue Science intitulé « Protoxyde d'azote : pas de quoi rire »[31], Donald J. Wuebbles (Département Atmospheric Sciences, School of Earth, Society, and Environment de l'université de l'Illinois) s'étonne qu'en dépit de son importance reconnue depuis longtemps comme gaz à effet de serre et destructeur de la couche d'ozone, l'oxyde nitreux semble parfois encore rester le gaz oublié dans les questions de protection de l'atmosphère, du climat ou de la couche d'Ozone. On continue à principalement se concentrer sur les émissions de dioxyde de carbone (CO2) et de méthane (CH4) provenant notamment des combustibles fossiles en oubliant que « les changements futurs du climat et de la répartition de l'ozone stratosphérique dépendent des émissions et de la concentration changeante de N2O dans l'atmosphère […] l'oxyde nitreux mérite beaucoup plus d'attention et de considération pour une action politique visant à contrôler les futures émissions anthropiques »[31].
Sa concentration dans l'atmosphère terrestre a atteint 329 ppb en 2016, soit +122 % par rapport au niveau préindustriel, contribuant pour 6 % au forçage radiatif induit par les gaz à effet de serre persistants[22].
Gaz destructeur de la couche d'ozone |
Le protoxyde d’azote (N2O) en excès contribue à la destruction de la couche d'ozone, en interaction avec d'autres gaz[32]. Il est considéré comme ayant une longue durée de vie dans la haute atmosphère (comme le CO2 et le méthane responsable en excès, à l’effet de serre[33], or le réchauffement peut exacerber le trou de la couche d'ozone et inversement[33]).
Dès le début des années 1970, des météorologues et scientifiques s'inquiètent de l'augmentation du taux de N2O dans la haute atmosphère[34], mais il n'a pas été inclus dans le Protocole de Montréal. Au début du XXIe siècle, suite au recul des émissions des gaz soumis au protocole de Montreal, le N2O est devenu le premier ennemi de la couche d'ozone, comme le soulignent plusieurs articles scientifiques, notamment en 2002[35], 2009[23] et 2013[29]. Et le GIEC prévoit qu'il devrait continuer à s'accumuler dans l'air[33], tendance confirmée par un article publié près de dix ans plus tard, en 2018 dans Science, et il devrait le rester durant tout le XXIe siècle[23] car la part de protéines animales dans alimentation humaine ne cesse de croître, associée à une production de fumier et de soja également croissante source d'oxyde nitreux. Selon un article de la revue Nature Geoscience, le lisier et le fumier perdent dans l'air 2 % environ de l'azote qu'ils contenaient et les engrais azotés 2,5 % ; ces deux sources introduisent dans l'atmosphère 2,8 millions de tonnes de N2O pour les lisiers et 2,2 millions de tonnes pour les engrais synthétiques (dont la production et le transport et l'épandage produisent aussi par ailleurs du CO2 qui aggrave l'effet de serre. L'industrie rejette bien moins de N2O (0,8 million de t/an environ) et la combustion de la biomasse (0,5 million de t/an).
De 1860 à 2005 le taux de N2O dans l'air serait passée de 270 à 319 ppb (parties par milliard, un taux de croissance assez comparable à celui du CO2).
Diverses stratégies d'atténuation des émissions de N2O sont possibles, dont en agriculture, où des changements techniques et de comportements pourraient considérablement réduire les émissions de N2O (et d'autres formes d'azote réactif), mais elles sont peu soutenues par l'industrie et les Etats[29]. Les Parties signataires du régime de l'ozone qui doivent appliquer la Convention de Vienne (1985) au travers de son Protocole de Montréal de 1987 pourraient aussi prendre des mesures pour gérer le N2O à l'avenir[29]. En 2017, par un amendement au protocole elles ont intégré les HFC, mais n'évoquent toujours pas le N2O. Des voies réglementaires claires permettraient pourtant de l'inclure dans le régime de protection de la couche d'ozone, en partageant l'autorité sur le N2O avec les traités internationaux (actuels et futurs) sur le climat. Selon Kanter et al. (2012), ce serait un moyen supplémentaire et précieux dans la gouvernance et diplomatie du développement durable[29].
Utilisations |
Il est utilisé dans le cadre d'anesthésies locales, généralement lors d'opérations hors hôpitaux (cas d'urgence) ou en cas de contre-indications. Ce gaz est aussi prisé de certaines soirées où ses effets sont détournés pour provoquer chez l'inhaleur des sensations de fous rires incontrôlés.
Usage médical |
Le protoxyde d'azote exerce un effet antalgique (apaise la douleur) et potentialise (augmente) l'effet des médicaments anesthésiques administrés en même temps. On l'utilise donc :
- en anesthésie, comme composante courante de l'anesthésie générale combinée, en association avec des anesthésiques injectables (hypnotiques, morphiniques, curares) ou inhalés ;
- en médecine d'urgence (réductions de fractures ou luxations), pédiatrie ou en salle d'accouchement, sous forme de mélange équimoléculaire avec du dioxygène (MEOPA) ;
- pour la pratique de gestes douloureux (MEOPA), en particulier chez l'enfant : prélèvement sanguin difficile, myélogramme, ponction lombaire, etc. Il a ici l'avantage d'induire souvent une amnésie du geste, utile quand celui-ci doit être répété. Pour une efficacité accrue, le protoxyde d'azote est ici associé à la prise préventive d'antalgiques, de type morphinique le plus souvent.
Le protoxyde d'azote fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[36].
Usage dans les moteurs à combustion interne |
Principe |
Du fait de sa teneur en oxygène plus élevée que l'air, le protoxyde d'azote est parfois utilisé comme appoint ou en substitution à ce dernier dans les moteurs à combustion interne[37]. Il permet d'augmenter la charge comburant/carburant dans le cylindre, de favoriser la combustion, et ainsi d'augmenter fortement la puissance du moteur (de 30 % à 100 % environ). On parle alors de moteur à protoxyde d'azote (en).
Aviation |
L'injection de protoxyde d'azote fut utilisée durant la Seconde Guerre mondiale dans certains avions de combat allemands. Un dispositif, nommé dispositif GM-1 (en), visait à compenser la diminution du dioxygène de l'air en altitude (gaz prélevé dans l'air, utilisé comme comburant par les moteurs à pistons), ce qui avait comme conséquence de réduire le niveau de comburant dans le moteur par rapport au carburant, et entraînait, ainsi, une baisse de la puissance délivrée par le moteur ainsi qu'une augmentation de la consommation[38]. L'injection de protoxyde d'azote visait donc à pallier le manque de comburant dans le moteur de manière à permettre à celui-ci de fonctionner à haute altitude avec un rendement identique à un fonctionnement à basse ou moyenne altitude. Le pilote disposait ainsi d'une réserve de puissance qu'il pouvait utiliser jusqu'à l'épuisement de la bonbonne contenant le protoxyde d'azote sous forme liquide, soit une dizaine de minutes.
À l'époque, ces systèmes étaient mal maîtrisés et requéraient une grande précaution d'emploi, surtout sur les moteurs très compliqués des appareils allemands. Un pilote souhaitant utiliser le GM-1 devait le faire à une altitude où l'air était déjà raréfié (à partir d'environ 6 000 m d'altitude) et devait réduire les gaz avant de relancer ceux-ci une fois le dispositif mis en route, sous peine de casser le moteur ou, pire, de faire exploser l'avion.
Compétition automobile |
Plus tard, et à l'instar des autres procédés de suralimentation tels que le compresseur et le turbo, le principe de l'injection de protoxyde d'azote fut repris en compétition automobile, puis par le particulier puisque l'on trouve sur le marché des kits NOS (Nitrous Oxide Systems) que l'on peut adapter sur à peu près n'importe quelle automobile. Bien que ces kits soient très prisés des amateurs de tuning automobile, leur installation sur des véhicules de série reste illégale dans de nombreux pays. L'utilisation en France reste autorisée du moment que la vanne de sécurité (obligatoire) de la bonbonne est verrouillée et qu'il n'en soit pas fait usage lorsque le véhicule équipé circule sur une voie publique ; cependant les assurances sont en droit de refuser de prendre en charge de tels véhicules.
Usage dit « récréatif » |
Le protoxyde d'azote, légalement vendu dans les commerces de proximité - théoriquement pour des siphons à chantilly - conditionné en bonbonnes ou cartouches d'acier de forme ovale, est (depuis deux décennies au moins) détourné à titre récréatif pour ses propriétés psychodysleptiques. Ce détournement du protoxyde d'azote est avéré aux États-Unis et au Royaume-Uni depuis le début des années 1980 et en France depuis 1996/1998 (premiers cas signalés par le centre antipoison de Marseille), dans les milieux étudiant notamment[14].
Ce n'est pas un produit qui inquiète les spécialistes de l'addiction, cependant s'il fait rire, que son effet est de relativement courte durée et qu'il n'induit généralement pas de dépendance, il ne s'agit pas non plus d'un produit tout à fait anodin ; Il peut être source d'une forme d'anémie particulière, d'atteintes neurologiques (poly-neuropathies, ataxies, c'est à dire troubles de l'équilibre, problèmes de coordination motrice) note William Lowenstein, spécialiste en médecine interne et addictologie, président de SOS Addictions[39]. Et selon les statistiques anglaises collectées par un rapport de l'université de Londres (cité par le quotidien The Independant), en six ans de 2006 à 2012, dix-sept jeunes britanniques sont morts après avoir consommé du gaz hilarant, dont six par asphyxie (hypoxie)[39].
Il est souvent partagé ou vendu à l'occasion de soirées techno, ou dans les free parties, les technivals, les soirées trance, etc.[39].
Le protoxyde d'azote semble faire l'objet de modes, avec un premier pic de consommation vers l'an 2000[39] et un regain constaté en 2017-2018 en France.
Il est le plus souvent inhalé par la bouche via des ballons gonflables de caoutchouc ou via des préservatifs gonflés de gaz (vendus à l'unité) selon un rapport[40] français rédigé par le Comité de coordination de toxicovigilance en 2007 à la demande de la direction générale de la Santé (DGS). Le conditionnement en ballons permet d'éviter des gelures, des embolies pulmonaires ou cérébrales causées par le froid généré par la détente du gaz (provenant d'une bombe de gaz dépoussiérant ou d'un siphon à Chantilly), mais le gaz est « parfois directement aspiré à la cartouche » note Drogues Info Service qui ajoute que « les effets fugaces du protoxyde d'azote incitent parfois l'usager à des inhalations répétées pouvant conduire à la mort par asphyxie »[39].
En 2011, l'Agence Nationale de sécurité du médicament et des produits de santé (ANSM) a mis en garde contre l'usage récréatif des substances volatiles en général et du protoxyde d'azote notamment (5,5 % d'entre eux disaient l'avoir déjà expérimenté en 2011)[39].
En 2014, Drogues Info Service n'avait reçu que peu de demandes d'aide ou d'information (quinze demandes sur 44 000 appels)[39].
Autres usages |
Le protoxyde d'azote est utilisé comme gaz propulseur, notamment dans les bonbonnes de crème Chantilly ou d'air sec pour les ordinateurs. Son code européen est le E942[41].
Dissous dans l'eau, le protoxyde d'azote a un goût sucré[42].
Il a été utilisé pour la conservation de la viande.
Toxicologie |
Les effets d'une exposition chronique à de faibles doses sont mal connus, mais ont été étudiés pour certains métiers exposés (anesthésistes en salles de chirurgie par exemple[43]).
À forte dose, il provoque des effets neurologiques (polynévrite avec spasticité) et une anémie macrocytaire, avec réduction du taux de vitamine B12 circulante. Smith, dans une revue des risques sanitaires chez le personnel hospitalier, rappelle qu'il s'agit d'un poison mitotique, qui a été rendu responsable de tumeurs du système lymphoïde et du système réticulo-endothélial chez le personnel intervenant en salle d'opération (avec échanges entre chromatides sœurs selon Saras et al. 1992, Eroglu et al.) chez lequel on a décrit diverses atteintes cytogénétiques (problèmes également posés par l'exposition à d'autres anesthésiques).
Le protoxyde d'azote à haute concentration a déjà provoqué des morts par asphyxie dues à un manque d'oxygène. Cependant, il faut rappeler que les mélanges gazeux employés en anesthésie contiennent toujours au moins 21 % d'oxygène (jusqu'à 50 % dans le cas du MEOPA), ce qui est la proportion d'oxygène dans l'air ambiant. Ces morts sont donc dues à un usage inapproprié et mal contrôlé.
L'usage détourné et prolongé de protoxyde d'azote présente des risques de complications médicales pour le nouveau-né en cas d'usage durant une grossesse[44].
Effets et conséquences, toxicité |
Les effets de court terme sont rapides et fugaces. Ils commencent de quinze à trente secondes après l'absorption et se terminent au bout de deux à trois minutes.
À forte dose, le protoxyde d'azote devient narcotique avec comme effets possibles[réf. souhaitée] :
euphorie, sensation de bien-être et fous rires ;- désinhibition ;
- effet de flottement ;
- distorsions visuelles et auditives ;
- sensation d'alourdissement des membres ;
- modification de la voix, qui devient très grave (effet inverse de l'hélium) ;
- pertes de mémoire ;
- spasmes ;
hypersalivation[réf. nécessaire].
Effets de doses importantes à court terme |
Nausées, vomissements
- Hypoxie
- Vertiges
- Risques de brûlures irréversibles causées par le froid si le gaz est inhalé ou mis en bouche au moment de sa décompression
Hallucinations[45]
Effets de doses importantes à long terme |
Un usage intense et régulier du protoxyde d'azote peut provoquer :
- une carence en vitamine B12[46] ;
- une réduction du taux de vitamine B12 circulante[47] par inhibition de la méthionine synthase hépatique[48], entraînant des troubles neurologiques tels que des tremblements ou des difficultés à coordonner ses mouvements ;
- une anémie ;
- des atteintes de la moelle osseuse et de la moelle épinière ;
- une dépendance psychologique.
Notes et références |
OXYDE NITREUX, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009.
(en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50.
Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
(en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
(en) « Properties of Various Gases », sur flexwareinc.com (consulté le 12 avril 2010).
(en) W. M Haynes, CRC Handbook of Chemistry and Physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40.
(en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0).
(en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, 18 juin 2002, 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
(en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
Entrée de « Nitrous oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire).
« Oxyde nitreux » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
La spectrométrie d'absorption atomique, sur culture.gouv.fr.
(en) Cotton F. A. et Wilkinson G. (1972), Advanced Inorganic Chemistry, a comprehensive text, 3e éd., Interscience Publishers, John Wiley & Sons, p. 355
Denis Richard, Jean-Louis Senon et Marc Valleur, Dictionnaire des drogues et des dépendances, Larousse, 2004(ISBN 2-03-505431-1).
Dr Daniel Annequin, Un an après la sortie du MEOPA de la réserve hospitalière. État des lieux, Unité Fonctionnelle de lutte contre la douleur Hôpital d’enfants Armand Trousseau de Paris, CNRD (consulté le 28 octobre 2018)
Rectificatif d’AMM en date du 30 novembre 2009Voir annexe 1)
Annexe 1 [PDF], sur cnrd.fr
https://www.cnrd.fr/IMG/pdf/DA_11.pdf
Groupe présidé par Dr Annequin, avec le Pr Corinne Lejus, les Dr Barbara Tourniaire, Elisabeth Fournier Charrière, Nada Sabourdin qui ont coordonné les sous groupes de travail ; le Dr Nathalie Dumarcet de l'AFSSAPS assurant la coordination générale. L’association PEDIADOL www.pediadol.org a contribué à la facilitation logistique de ces recommandations
http://www.afssaps.fr/var/afssaps_site/storage/original/application/7b8bf3b0175d7c1ef72e65079ac4e56 e.pdf
Rectificatif d’AMM, 30 novembre 2009 (voir annexe 3)
« Montée en flèche des concentrations de gaz à effet de serre : nouveau record », sur OMMM, 30 octobre 2017(consulté le 15 septembre 2018).
(en) Ravishankara A.R, Daniel J.S et Portmann R.W (2009), Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century [PDF], Science, 326(5949), 123-125.
Tallec G. (2005), Émissions d’oxyde nitreux lors du traitement de l’azote en station d’épuration, agglomération parisienne (Doctoral dissertation, Marne-la-Vallée, ENPC).
Crutzen P.J. et Ehhalt D.H. (1977), Effects of nitrogen fertilizers and combustion on the stratospheric ozone layer, Ambio, 112-117.
Perkins S. (2019), Leafcutter ant ‘compost piles’ produce potent greenhouse gases, 1er janvier 2019.
« Protoxyde d'azote - N2O », sur citepa.org, 2 août 2016(consulté le 4 août 2016).
« Le protoxyde d’azote, un gaz à effet de serre qui ne fait rire personne », sur inra.fr, 13 février 2015(consulté le 4 août 2016).
(en) Kanter D., Mauzerall D.L., Ravishankara A.R., Daniel J.S., Portmann R.W., Grabiel P.M., … et Galloway J.N. (2012), A post-Kyoto partner: considering the stratospheric ozone regime as a tool to manage nitrous oxide [PDF], Proceedings of the National Academy of Sciences, 201222231
(en) Direct Global Warming Potentials p. 212
Wuebbles D.J. (2009), Nitrous oxide: no laughing matter, Science, 326, 5949, 56-57.
Portmann R.W, Daniel J.S. et Ravishankara A.R. (2012), Stratospheric ozone depletion due to nitrous oxide: influences of other gases, Phil. Trans. R. Soc. B, 367 (1593), 1256-1264.
(en) Menon S., Denman K.L., Brasseur G., Chidthaisong A., Ciais P., Cox P. M., … et Jacob D. (2007), Couplings between changes in the climate system and biogeochemistry (no LBNL-464E), Lawrence Berkeley National Lab. (LBNL), Berkeley, CA (États-Unis)
(en) Crutzen P.J. (1970), The influence of nitrogen oxides on the atmospheric ozone content [PDF], Quarterly Journal of the Royal Meteorological Society, 96(408), 320-325.
Randeniya, L. K., Vohralik, P. F. et Plumb, I. C. (2002), Stratospheric ozone depletion at northern mid latitudes in the 21st century: The importance of future concentrations of greenhouse gases nitrous oxide and methane. Geophysical research letters, 29(4).
WHO Model List of Essential Medicines, 18th list, avril 2013.
« Le protoxyde d'azote (Nitrous oxyde) », sur Mecamotors
« Fuels & Fluids Used By Germany: GM-1 », sur Luftwaffe Ressource Center.
Lise Loumé (2015), « Un Britannique de 18 ans meurt après avoir inhalé du gaz hilarant », Science et Avenir, 29 juillet 2015
Comité de coordination de toxicovigilance (2007), Rapport : Déviation d’utilisation du protoxyde d’azote commandé par la direction générale de la Santé, 20 février 2007
Parlement européen et Conseil de l'europe, « La directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », Journal officiel, no L 61, 1995(résumé, lire en ligne)
J. Cutayar et J.-L. Pean, Utilisation du protoxyde d'azote (N2O) ou d'un mélange de gaz comportant du protoxyde d'azote comme agent édulcorant de produits agroalimentaires, World Patent WO/2007/090939
Robert R. Lauwerys, Vincent Haufroid et Perrine Hoet, Toxicologie industrielle et intoxications professionnelles (extrait)
Protoxyde d'azote, brochure éditée et distribuée par l'association Spiritek en partenariat avec les villes de Lille et de Tourcoing, la communauté urbaine Lille-Métropole et le conseil général du département Nord.
[1]
(en) Michel Hautefeuille et Dan Véléa, Les drogues de synthèse, Presses Universitaires de France, coll. « Que sais-je ? » (no 3625), 2002, 127 p. (ISBN 978-2-130-52059-7, OCLC 300468465)
(en) Michael A. Miller, Vicky Martinez, Richard McCarthy et Manish M. Patel, « Nitrous oxide whippit abuse presenting as clinical B12 deficiency and ataxia », American Journal of Emergency Medicine, vol. 22, no 2, mars 2004 (lire en ligne).
Deacon R., Lumb M., Perry J. et al., Inactivation of methionine synthase by nitrous oxide, Eur. J. Biochem, 1980, 104:419–423
Voir aussi |
Article connexe |
- Société Air liquide
Liens externes |
Fiche renseignement Air liquide.
Fiche internationale de sécurité du protoxyde d'azote [PDF] sur le site de l'INRS.
Fiche protoxyde d'azote sur le site de l'ADEME.
Fiche protoxyde d'azote sur le site de l'INRA.
(en) Nitrous Oxide [PDF] sur NIOSH Resources.
Fiche protoxyde d'azote sur le site de Drogues info service.
Bibliographie |
- Schilt A. et al. (2010), Atmospheric nitrous oxide during the last 140,000 years, Earth Planet. Sci. Lett., 300, 33–43.
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie







