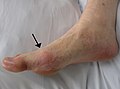
Goutte (maladie)
La goutte
Dessin humoristique de James Gillray (1799).
| Spécialité | Rhumatologie |
|---|---|
| Symptôme | Arthralgie, hydarthrose, érythème et tuméfaction |
CISP-2 | T92 |
|---|---|
CIM-10 | M10 |
CIM-9 | 274.00 274.1 274.8 274.9 |
| OMIM | 138900 300323 |
| DiseasesDB | 29031 |
| MedlinePlus | 000422 |
| eMedicine | 329958, 241767 et 389965 |
| eMedicine | emerg/221 med/924med/1112oph/506orthoped/124radio/313 |
| MeSH | D006073 |
![]() Mise en garde médicale
Mise en garde médicale
La goutte est une maladie chronique fréquente liée au métabolisme de l'acide urique, dont la manifestation clinique la plus caractéristique est une monoarthrite aiguë du gros orteil. Elle est associée, bien que de façon inconstante, à une augmentation du taux circulant d'acide urique (hyperuricémie). Son évolution sans traitement se fait vers le dépôt d'acide urique dans plusieurs sites de l'organisme avec une prédilection pour les articulations (arthrite goutteuse), la peau (tophus) et les reins (néphropathie uratique), conduisant au maximum à des destructions articulaires invalidantes et à une insuffisance rénale terminale potentiellement fatale.
La cause exacte de la goutte reste inconnue. Une composante génétique est probable du fait de la fréquence des formes familiales et de la prévalence chez les sujets de sexe masculin, mais les facteurs environnementaux jouent un rôle non négligeable dans sa survenue : surpoids, consommation régulière d'alcool, alimentation riche en purines (viande rouge et abats notamment). Cependant, toutes les causes d'hyperuricémie ne sont pas des causes de goutte (il y a dans la population un sujet goutteux pour dix sujets hyperuricémiques).
La prise en charge thérapeutique de la goutte comprend un volet symptomatique (soulagement des crises par les anti-inflammatoires non stéroïdiens ou par la colchicine) et un traitement de fond (règles hygiéno-diététiques et dans certains cas médicaments hypo-uricémiants).
Sommaire
1 Historique
2 Physiopathologie
3 Épidémiologie
4 Clinique
4.1 La crise de goutte
4.2 Tophus
5 Diagnostic
6 Complications
7 Prévention
8 Traitement
8.1 Traitement de la crise fluxionnaire
8.2 Traitement de la maladie goutteuse
8.3 Prévention des crises de goutte sous traitement
8.4 Traitement de l'hyperuricémie majeure
9 Voir aussi
9.1 Articles connexes
10 Notes et références
Historique |
La goutte est une maladie ancienne, décrite dès la Rome antique. La confirmation diagnostique n'est cependant faite que lorsqu'on retrouve des cristaux d'urates caractéristiques dans des tissus biologiques conservés jusqu'à nos jours. C'est le cas en particulier sur un doigt momifié de Charles Quint conservé au monastère Royal San Lorenzo de l'Escurial et examiné au microscope[1].
Pour désigner la goutte, Hippocrate utilise au Ve siècle av. J.-C., le mot « podagra » (d'où le français « podagre », n.f. désignant la maladie, ou n.m. désignant une personne goutteuse), qui est avant tout descriptif puisqu'il signifie en grec « pris par le pied » évoquant le piège dans lequel l’animal est capturé (pous désigne le pied et agra la chasse, prise)[2].
Asclépiade de Bithynie (124-40 av. J.-C.) propose la pratique de saignées pour guérir cette affection, ce que confirme Galien qui intègre la goutte dans le système des quatre humeurs.
Jacques le Psychriste surnommé le Phidias de la médecine, byzantin du Ve siècle, introduit le colchique (hermodacte) dans le traitement de la goutte.
La podagre est souvent évoquée pour nommer les affections rhumatismales par les médecins de cette époque. Avicenne en fait une remarquable description dans son fameux Canon.
C’est au IXe siècle que le mot goutte est introduit dans le langage populaire, le rheuma (rhumatisme) est comparé à une humeur nocive distillée « goutte à goutte » dans les jointures mais aussi les organes.
Son sens se restreint au XVe siècle, le mot goutte correspondant à l’affection désignée sous le terme de podagre.
À la Renaissance, Ambroise Paré intègre finalement le terme « Goutte » en lieu et place de podagre. Les Anglais emploient le terme « Gout », les italiens « Gotta », les Espagnols « Gota» et les Allemands « Gicht ».
Le XVIIe siècle marque une révolution dans l’histoire de la rhumatologie avec la classification du médecin parisien Guillaume de Baillou, qui distingue la goutte du rhumatisme et de l’arthritis.
Les descriptions de la goutte dans l’histoire sont nombreuses et anciennes, mais la plus fondatrice est le traité de la podagre de Thomas Sydenham, surnommé « l’Hippocrate anglais » paru en 1683 (Tractatus de Podagra et Hydrope).
Physiopathologie |

Cristal d'urate dans du liquide synoviale (la tache blanche au milieu de l’image, en arrière-plan ce sont des neutrophiles qui apparaissent plus foncés)
La goutte est due à une cristallisation d'acide urique. Son origine est multiple. D'une part, il est le déchet formé par la dégradation des purines. En temps normal, elles sont synthétisées à partir du ribose-5-phosphate qui est transformé au bout de plusieurs réactions en acide inosinique, porteur d'un noyau purique. Cet acide entre alors dans un cycle long qui conduit à la synthèse d'adénine ou de guanine, composants de l'ADN. Ces derniers pourront être dégradés plus tard en xanthine, puis, grâce à la xanthine oxydase, en acide urique, que le rein élimine dans les urines. Comme la synthèse d'acide inosinique dépasse largement les besoins de l'organisme, il existe aussi un cycle court où cette molécule est directement dégradée en xanthine. La goutte peut provenir d'un emballement du cycle court qui aboutit à un excès d'acide urique dans le sang.
D'autre part, il peut provenir de la dégradation des nucléotides puriques (adénine et guanine) présents dans les cellules. Cela explique pourquoi une goutte peut se déclencher lorsque de nombreuses cellules sont détruites, par exemple pendant un traitement anticancéreux.
Enfin, les nucléotides puriques présents dans l'alimentation subissent le même sort que ceux de l'organisme. C'est pourquoi la goutte est plus fréquente chez les personnes qui consomment beaucoup d'aliments riches en purines (viande, crustacés, etc.)
Il existe une maladie génétique rare, le syndrome de Lesch-Nyhan, où le déficit d'une enzyme, l'hypoxanthine-guanine-phosphoribosyltransférase, conduit également à un emballement du cycle court, mais de façon plus sévère. Ce syndrome apparaît dans l'enfance et est caractérisé par une maladie goutteuse et un retard mental ainsi qu'une tendance à l'automutilation.
Cependant, les gouttes par excès de production d'acide urique ne représentent qu'une minorité. La plupart du temps, le taux élevé de cette substance dans le sang (hyperuricémie) est dû, soit à une insuffisance rénale, le rein n'étant plus capable d'éliminer correctement les déchets, soit à un défaut d'élimination rénale d'origine génétique[3]. Souvent, une crise de goutte est déclenchée par la prise d'un médicament (notamment un diurétique). Celui-ci entre en compétition avec l'acide urique : le rein ne peut pas éliminer les deux substances à la fois, car elles ont des propriétés chimiques semblables. Du coup la quantité d'acide urique éliminé diminue et l'acide urique non éliminé s'accumule donc dans le sang.
Lorsque l'hyperuricémie devient importante, l'acide urique risque de précipiter sous forme de cristaux. Cela se produit au niveau des articulations, surtout les plus froides et les plus soumises à des traumatismes microscopiques, c'est-à-dire principalement le gros orteil.
Épidémiologie |
La goutte est plus fréquente chez l'homme et augmente en fréquence avec l'âge. Elle touche près de 1 % de la population. Elle se déclenche typiquement chez les hommes pléthoriques (mangeant beaucoup et ne faisant pas d’exercice) à partir de 50 ans. Sa fréquence tend à s'accroître, probablement en rapport avec la longévité en augmentation et le mode de vie[4].
Aux États-Unis, la prévalence auto-déclarée de la goutte au cours de toute une vie est estimée à près de 4 % dans la population générale, ce pourcentage étant en augmentation depuis plus de 40 ans[5].
Même si elle est étroitement liée avec l'hyperuricémie, la présence de cette dernière ne rend pas obligatoire la crise de goutte : seules 10 % des hyperuricémies déclenchent des maladies goutteuses[réf. nécessaire].
Elle est plus fréquente chez les personnes obèses (notamment dans le cadre d'un syndrome métabolique[6]) ou avec une consommation d'alcool excessive[7] (essentiellement chez les buveurs de bières[8], probablement par la richesse en purines du breuvage). Elle est favorisée par une plus grande consommation de viandes ou de produits de la mer[9]. Elle serait également plus fréquente chez les consommateurs de fructose que cela soit sous forme de sucre (sodas et boissons sucrées) ou de fruits[10]. La caféine serait, au contraire, protectrice[11].
Les femmes seraient relativement protégées, du moins avant la ménopause, probablement du fait de l'action uricosurique de l'œstrogène, qui fait baisser ainsi le taux d'acide urique sanguin[12].
Il existe un terrain génétique et plusieurs gènes semblent intervenir : SLC22A12, SLC2A9 (GLUT9), ABCG2, et SLC17A3 dont les mutations augmentent sensiblement le risque de survenue d'une goutte[13].
La prise de diurétiques augmente le risque de survenue de la maladie[14].
Clinique |
La crise de goutte |
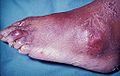
La fluxion goutteuse se présente par une douleur soudaine et vive et par le gonflement d'une articulation. Elle n'atteint en général qu'une articulation par crise et d'abord les orteils, en particulier la base du gros orteil, avec l'articulation métatarso-phalangienne[15] (on parle de « podagre », ce qui signifie « pris par le pied dans un piège », soulignant pour les anciens l'intensité de la douleur) mais aussi parfois les chevilles, les talons, les genoux et, beaucoup plus tardivement les articulations des doigts et les poignets. Cette douleur qui se déclenche souvent la nuit, est insomniante et empêche tout contact avec l'articulation (même avec les draps du lit). Le pic d'intensité douloureuse est atteint en moins d'une journée et la crise se résout spontanément en une à deux semaines[16]. Sans traitement, elles se répètent avec des intervalles libres de plus en plus courts.
Inflammation douloureuse au niveau de l'articulation métatarso-phalangienne du gros orteil.

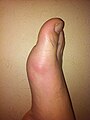
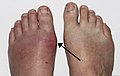

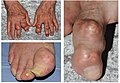
Tophus |
Un tophus (pluriel : des tophi) est un dépôt d'urates de sodium dans le tissu sous-cutané. Il se forme des agrégations d'urates qui donnent des nodules blanchâtres durs de la peau, ces dépôts sont insensibles et peu symptomatiques. Ils siègent typiquement en regard d'articulations ayant souffert d'arthrite goutteuse et aussi : sur le pavillon de l'oreille, les faces postérieures des coudes, les doigts, etc.

Des nodules sur un doigt et une oreille correspondant à des tophi.

Tophus d'un genou.
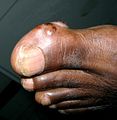
Tophus sur un orteil et au-dessus de la malléole externe.
Goutte compliquée d'une rupture de tophus (exsudat contenant des cristaux d'urates de sodium).

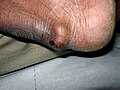
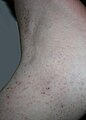
Diagnostic |
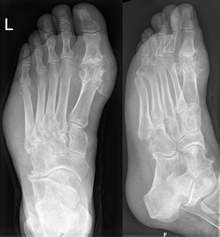
La radiographie est classiquement normale, sauf chez un patient présentant une goutte chronique et pouvant alors avoir des atteintes osseuses ou articulaires.
Le diagnostic est bien souvent évident sur la description de l'atteinte articulaire et il n'est pas alors besoin de pousser plus avant les explorations.
En cas de doute, la recherche des microcristaux d'urate au microscope dans le liquide de ponction de l'articulation atteinte assure le diagnostic (cristaux négativement biréfringents[17]).
Le taux sanguin d'acide urique (uricémie) peut diminuer, voire se normaliser, durant la crise et un dosage normal n'exclut donc pas le diagnostic[16]. Il faut alors répéter le dosage quelques semaines plus tard. Le seuil normal d'acide urique dans le sérum est de 70 mg/L, soit 420 µmol/L. Au-delà de ces quantités, on parle d'hyperuricémie. Attention à ne pas faire un faux diagnostic de goutte chez une personne avec une simple arthrose du gros orteil ou du genou et une hyperuricémie.
Les radiographies sont normales au début et ne servent qu'à exclure un autre diagnostic. En revanche elles servent à rechercher les conséquences osseuses ou articulaires de la goutte chronique (arthropathie goutteuse).
Une fois le diagnostic fait il faut vérifier le fonctionnement du rein (créatininémie avec sa clairance), mais aussi rechercher les composants du syndrome métabolique : hypertension artérielle, diabète sucré, excès de lipides sanguins (hypertriglycéridémie, taux bas de « bon » cholestérol HDL) et augmentation du périmètre de l'abdomen.
Complications |
Lorsque la cause de la goutte, l'hyperuricémie, n'est pas traitée, la maladie devient chronique. Les dépôts de cristaux d'urate deviennent de plus en plus nombreux. C'est alors que l'on peut constater la présence de tophus. Cependant, les cristaux se déposent aussi au niveau des articulations, ce qui provoque une destruction du cartilage et des os avec des douleurs à chaque mouvement, et surtout au niveau du rein, où ils sont responsables d'une évolution vers l'insuffisance rénale, qui fait toute la gravité de la maladie. L'acide urique peut également précipiter dans l'urine, sous la forme de calculs (lithiase urinaire), qui bloquent les voies urinaires et y déclenchent des spasmes très douloureux (colique néphrétique).
La goutte serait un facteur de risque de survenue d'une maladie cardio-vasculaire indépendant[7].
Prévention |
L'Égopode podagraire, plante commune comestible des sous-bois est réputée en usage interne depuis l'Antiquité pour lutter contre la goutte[18].
Une équipe de chercheurs de l'université de la Colombie-Britannique (Vancouver) et de l'école de santé publique d'Harvard (Boston) a mis en évidence début 2007 que ceux qui boivent le plus de café ont moins de risque que les autres d'avoir des crises de goutte[19]. Le risque de goutte serait inférieur de 40 % chez les personnes buvant 4 à 5 tasses de café par jour et de 61 % au-delà. L'effet est encore plus marqué chez les hommes qui ne prennent pas de diurétiques, un autre facteur de risque de développer cette maladie. Chez ces derniers, la consommation de 6 tasses de café ou plus est associée à une diminution de 70 % du risque de goutte.
Une autre étude a montré que ceux qui boivent quatre à cinq tasses de café par jour ont un taux moyen d'acide urique inférieur de 0,26 mg/dL en moyenne par rapport à ceux qui n'en boivent pas du tout[20].
Traitement |
Il y a trois vecteurs de traitement pour la goutte :
- soulager la douleur des crises de goutte,
- réduire le taux d'acide urique dans le sang (emploi d'un hypo-uricémiant),
- prévenir la récidive des crises de goutte sous traitement hypo-uricémiant.
Traitement de la crise fluxionnaire |
Lors de la crise aiguë très douloureuse, le traitement doit être rapidement efficace et comprend le repos, des mesures physiques telles que la protection de l'articulation par un arceau et l'application de glace, des médicaments anti-inflammatoires, ainsi qu'une modification du régime alimentaire et notamment la suppression des boissons alcoolisées.
Pour soulager la douleur, on utilise des anti-inflammatoires non stéroïdien (AINS, comme l'indométhacine, le naproxène), et des antalgiques simples (paracétamol) ou de palier 2. L'aspirine doit être évitée, car elle interfère avec l'élimination urinaire de l'acide urique.
Appliquer de la glace localement, en protégeant bien la peau avec un linge (10 à 30 minutes 4 fois par jour) raccourcit la durée de la crise et soulage aussi la douleur[21].
La colchicine est employée fréquemment en France mais beaucoup moins dans les pays anglo-saxons en raison de ses effets secondaires : diarrhée, etc. Toutefois cette différence s'explique par la connaissance imparfaite de sa prescription. Elle est aussi efficace qu'un AINS et bien tolérée à condition de :
- commencer le traitement le plus tôt possible, dès les premiers symptômes ;
- prendre d'abord un comprimé d'un milligramme (en France) ou deux comprimés à 0,6 mg (dans les pays anglo-saxons) que l'on renouvelle une heure plus tard à raison d'un demi-comprimé à 1 mg (en France) ou un comprimé à 0,6 mg (dans les pays anglo-saxons), soit 1,5-1,8 mg le premier jour[22], à poursuivre les jours suivants à raison d'un ou d'un comprimé et demi pendant 10-15 jours.
Traitement de la maladie goutteuse |
L'objectif du traitement est de diminuer l'uricémie en dessous de 60 mg/L (360 µmol/L)[23], voire 50 mg/L (300 µmol/L) pour les rhumatologues britanniques. Il fait appel à des mesures non médicamenteuses (régime et modifications diététiques) et médicamenteuses (hypo-uricémiants).
Il faut veiller à arrêter quand on peut les médicaments qui augmentent l'acide urique comme les diurétiques utilisés dans le traitement de l'hypertension artérielle.
Un amaigrissement est souhaitable ainsi qu'une diminution significative de la prise d'alcool. La principale mesure est de réduire ou d'arrêter l'alcool. En particulier la bière doit absolument être arrêtée car elle contient des purines qui vont être dégradées en acide urique (curieusement la bière sans alcool expose au même risque d'hyperuricémie). Les alcools forts (cognac, whisky, etc.) doivent aussi être arrêtés. Le vin peut encore être consommé en quantité acceptable (2-3 verres par jour chez l'homme, 1-2 verres par jour chez la femme)[24].
Les boissons sucrées riches en fructose sont aussi un élément à réduire considérablement en les remplaçant par des boissons allégées. Le fructose que les sodas contiennent expose à une hyperuricémie et à la goutte[10].
Le régime diététique est encouragé avec une nourriture pauvre en purines :
- éviter les abats, les anchois, les consommés, les fruits de mer, les asperges, les épinards, les légumineuses (lentilles...), viande rouge, oseille, fraises, myrtilles (bleuets pour les québécois), choux, poisson fumé, saumon, alcools (surtout la bière).
- consommer de préférence : produits laitiers faibles en gras (effet uricosurique, viandes blanches, c'est-à-dire favorisant l'élimination urinaire de l'acide urique), pain (sans farine blanche), pommes de terre, riz, thon, cerises, céleri. D'une façon globale il faut réduire les apports caloriques[25].
La prise de vitamine C (500 mg j−1 pendant 2 mois) diminue l'uricémie et pourrait diminuer le risque de survenue de goutte[26].
Lorsque les crises sont trop fréquentes, lorsqu'il y a des tophus ou lorsque la goutte dégrade le cartilage et l'os, il faut alors réduire le taux d'acide urique dans le sang. Le médicament le plus prescrit est l'allopurinol. Il est bien connu des médecins, est efficace et peu onéreux. Sa tolérance est bonne. Toutefois des éruptions cutanées peuvent survenir. En cas d'allergie, en particulier cutanée, à l'allopurinol, ce médicament doit être immédiatement arrêté et ne JAMAIS être repris : le risque est en effet de développer alors un syndrome d'hypersensibilité médicamenteuse (DRESS Syndrome) très sévère.
En cas d'allergie ou d'intolérance (maux de tête par exemple), ou d'efficacité partielle, d'autres médicaments sont aussi capables de faire baisser l'acide urique en excès en augmentant son élimination par les reins (on parle d'uricosuriques) : il s'agit en Europe du probénécide et de la benzbromarone. En France, le premier est disponible en pharmacie d'officine, le second nécessite une autorisation temporaire d'utilisation préparée par un médecin hospitalier. Dans les deux cas ils sont contre-indiqués en cas de calculs rénaux d'acide urique ou de maladie du foie. Ils sont remarquablement efficaces. Leur surveillance est simple : assurer des boissons suffisantes pour diluer les urines et alcaliniser les urines avec de l'eau de Saint Yorre ou Vichy Célestins, du jus de citron frais ou des préparations pharmaceutiques ad hoc. Une autre solution possible est le febuxostat, un inhibiteur de la xanthine oxydase.
Prévention des crises de goutte sous traitement |
La baisse de l'acide urique va dissoudre les amas de cristaux articulaires, les tophi (tophus), et être alors la cause de nouvelles crises de goutte. Ces crises sont prévisibles et on peut les éviter en partie en prenant en même temps que l'allopurinol par exemple, de la colchicine à faible dose (1 mg j−1) tous les jours pendant plusieurs mois : au moins 3 mois, au mieux 6 mois, voire plus. Cela permet de réduire le nombre des crises de goutte sans les faire disparaître totalement.
Cela doit bien être expliqué, rappelé et compris du patient qui pourrait sinon croire que le traitement hypo-uricémiant n'est pas efficace. Au contraire, ces accès en début de traitement assurent que les stocks d'urate se réduisent peu à peu. Les accès goutteux vont s'espacer et il faut donc accepter cet inconvénient car, de fait, le traitement venant à bout des stocks d'urates, la goutte va guérir. Les crises vont s'espacer puis disparaître, de même que les tophi. C'est d'ailleurs la seule maladie rhumatologique que les médecins peuvent guérir [réf. nécessaire].
Depuis 2008, un autre hypo-uricémiant, le febuxostat a obtenu son autorisation de mise sur le marché en Europe. Aux États-Unis, il a eu l'agrément de la Food and Drug Administration en février 2009 et est aussi disponible. Comme l'allopurinol, il s'agit d'un inhibiteur de la xanthine oxydase, enzyme intervenant dans la synthèse de l'acide urique, mais cette inhibition est plus spécifique. Il agit. Il pourra trouver un intérêt en cas d'insuffisance rénale (contre-indication au probénécide, limitation de la dose journalière d'allopurinol du fait de la fonction rénale) ou d'allergie cutanée à l'allopurinol. Il induit une baisse plus importante du taux d'acide urique que l'allopurinol, mais avec parfois des crises de gouttes plus fréquentes en début de traitement[27], imposant une coadministration avec de la colchicine.
D'autres molécules sont en cours de test : l'uricase est une enzyme dégradant l'acide urique. Sa forme stabilisée est le pégloticase. Il diminue significativement l'uricémie ainsi que la taille des tophi, avec une augmentation du risque d'accès goutteux en début de traitement[28]. La molécule perd de son efficacité à moyen terme du fait de la formation d'anticorps[29].
Traitement de l'hyperuricémie majeure |
Le traitement hospitalier de l'hyperuricémie majeure (dans le cadre de chimiothérapie) emploie l'uricozyme.
Voir aussi |
.mw-parser-output .autres-projets ul{margin:0;padding:0}.mw-parser-output .autres-projets li{list-style-type:none;list-style-image:none;margin:0.2em 0;text-indent:0;padding-left:24px;min-height:20px;text-align:left}.mw-parser-output .autres-projets .titre{text-align:center;margin:0.2em 0}.mw-parser-output .autres-projets li a{font-style:italic}
Articles connexes |
- Rhumatologie
- Arthrite
Notes et références |
(en) J Ordi, P Alonso, J de Zulueta, J Esteban, M Velasco, E Mas, E Campo, P Fernández « The Severe Gout of Holy Roman Emperor Charles V » New Engl J Med 2006,355,516-520
Affections rhumatismales dans la peinture artistique Drs JF. Marc, R. Trèves, B. Bouret, Livre Numérique sur www.cimpppa.com.
(en) Merriman TR, Dalbeth N. « The genetic basis of hyperuricaemia and gout » Joint Bone Spine 2010.
(en) Saag KG, Choi H « Epidemiology, risk factors, and lifestyle modifications for gout » Arthritis Res Ther 2006;8 (suppl 1):S2
(en) Lawrence RC, Felson DT, Helmick CG, Arnold LM, Choi H, Deyo RA, Gabriel S, Hirsch R, Hochberg MC, Hunder GG, Jordan JM, Katz JN, Kremers HM, Wolfe F; National Arthritis Data Workgroup. « Estimates of the prevalence of arthritis and other rheumatic conditions in the United States. Part II » Arthritis Rheum. 2008;58(1):26-35. DOI:10.1002/art.23176
Choi HK, Ford ES, Li C, Curhan G, Prevalence of the metabolic syndrome in patients with gout: the third national health and nutrition examination survey, Arthritis Rheum, 2007;57:109-15
Roddy E, Doherty M, Epidemiology of gout, Arthritis Res Ther, 2010;12:223
Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G, Alcohol intake and risk of incident gout in men: a prospective study, Lancet, 2004;363:1277-81
Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G, Purine-rich foods, dairy and protein intake, and the risk of gout in men, N Engl J Med, 2004;350:1093-103
(en) Choi HK, Curhan G, « Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study », BMJ 2008;336:309-12.
Choi HK, Willett W, Curhan G, Coffee consumption and risk of incident gout in men: a prospective study, Arthritis Rheum, 2007;56:2049-55
(en) Richette P, Bardin T, « Gout », Lancet 2010;375:318-28.
Merriman TR, Dalbeth N, The genetic basis of hyperuricaemia and gout, Joint Bone Spine, 2011;78:35-40
Hueskes BA, Roovers EA, Mantel-Teeuwisse AK, Janssens HJ, van de Lisdonk EH, Janssen M, Use of diuretics and the risk of gouty arthritis: a systematic review, Semin Arthritis Rheum, 2012;41:879-89
Roddy E, Revisiting the pathogenesis of podagra: why does gout target the foot?, J Foot Ankle Res, 2011;4:13
Roddy E, Mallen CD, Doherty M, Gout, BMJ, 2013;347:f5648
[PDF] Média:Atlas des cellules et cristaux du liquide synovial-A-Lussier.pdf
Jean-Claude Rameau, Dominique Mansion, Gérard Dumé et al., Flore forestière française, guide écologique illustré : montagnes, Paris, Nancy, Institut pour le développement forestier : Direction de l'espace rural et de la forêt ; École nationale du génie rural des eaux et forêts, 1989, 2434 p. (OCLC 489627625, lire en ligne), p. 911.
(en) Hyon K. Choi, Walter Willett, Gary Curhan, « Coffee consumption and risk of incident gout in men: A prospective study » dans Arthritis & Rheumatism 2007;56(6):2049-2055.
(en) Hyon K. Choi, Gary Curhan « Coffee, tea, and caffeine consumption and serum uric acid level: The third national health and nutrition examination survey » dans Arthritis Care & Research 2007;57(5):816-821.
(en) Schlesinger N et al. « Local ice therapy during bouts of acute gouty arthritis », J Rheumatol 2002
(en) « EULAR evidence based recommendations for gout. Part II: Management » Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) Ann Rheum Dis 2006 Oct;65(10):1312-24.
(en) Perez-Ruiz F, Lioté F, « Lowering serum uric acid levels: what is the optimal target for improving clinical outcomes in gout? » Arthritis Rheum. 2007;57:1324-8
(en) Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G, « Alcohol intake and risk of incident gout in men: a prospective study » Lancet 2004;17(363):1277-81.
Bertrand Durantet, « Goutte : que manger ? », 2011(consulté le 24 mai 2017)
(en) Choi HK, Gao X, Curhan G. « Vitamin C intake and the risk of gout in men, a prospective study » Arch Intern Med. 2009;169:502-7.
(en) Burns CM, Wortmann RL, « Gout therapeutics: new drugs for an old disease » Lancet 2011;377:165-177
(en) Baraf HS, Becker MA, Edwards NL et al. « Tophus response to pegloticase (PGL) therapy: pooled results from GOUT1 and GOUT2, PGL phase 3 randomized, double blind, placebo-controlled trials » Arthritis Rheum. 2008;58:S176
(en) Wright D, Sundy JS, Rosario-Jansen T. « Routine serum uric acid (SUA) monitoring predicts antibody-mediated loss of response and infusion reaction risk during pegloticase therapy » Arthritis Rheum. 2009;60:S413
- Portail de la médecine